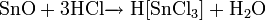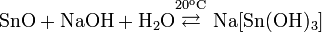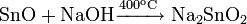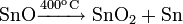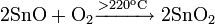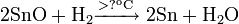Химия - Оксид цезия
28 февраля 2011Оксид цезия — Cs2O, неорганическое бинарное соединение цезия с кислородом. Оранжево-красные гексагональные кристаллы, расплывающиеся во влажном воздухе. При нагревании становится сперва тёмно-красным, затем — чёрным. После охлаждения цвет постепенно восстанавливается.
Возгоняется в вакууме при температуре менее 500 °C. Под действием света темнеет и разлагается. При нагревании свыше 300 °C диспропорционирует:
Энергично реагирует с водой и растворами кислот:
С влажным CO2 образует карбонат и гидрокарбонат:
При нагревании вступает в реакцию с водородом, фтором и хлором, расплавленной серой:
С жидким аммиаком реагирует, образуя амид цезия:
Получают оксид цезия осторожным нагреванием избытка цезия в атмосфере кислорода с последующей вакуумной отгонкой Cs:
В качестве побочных продуктов могут образовываться пероксид и надпероксид цезия, а также другие бинарные соединения цезия с кислородом переменного состава: Cs11O3, Cs4O, Cs7O и другие.
Применяют оксид цезия как компонент сложных фотокатодов и катализаторов в органическом синтезе.
Просмотров: 2013
|
|