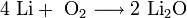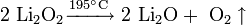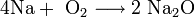Химия - Пероксид бария
28 февраля 2011Свойства
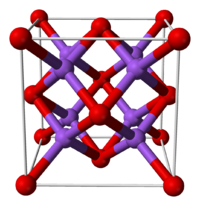
Соединение представляет собой белый или темно-серый порошок, плохо растворимый в воде . С водой образует кристаллогидраты BaO2•8H2O и BaO2•H2O.
Получение
1. Нагревание оксида бария BaO в среде кислорода при 500 °C:
2. Сильное прокаливание Ba2, BaCO3 или Ba2 в токе воздуха в присутствии следов воды.
Химические свойства
- Взаимодействует с серной кислотой, образует нерастворимый сульфат бария и пероксид водорода:
- При нагревании свыше 500 °C разлагается:
- При нагревании в избытке кислорода под высоким давлением получают надпероксид бария BaO4 — неустойчивое жёлтое вещество, которое легко разлагается в воде с выделением кислорода:
- При нагревании с озоном в атмосфере фреона образуется озонид бария BaO6.
Применение
- Для лабораторного получения пероксида водорода;
- Источник чистого O2;
- Компонент пиротехнических составов;
- Отбеливатель для ткани, бумаги.
Просмотров: 2675
|
|