Химия - Правило Клечковского
01 марта 2011Оглавление:
1. Правило Клечковского
2. Формулировка правила Клечковского
3. Исключения из правила Клечковского
Правило Клечковского — эмпирическое правило, описывающее энергетическое распределение орбиталей в многоэлектронных атомах.
Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел 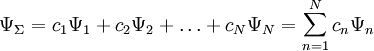 . При одинаковой сумме раньше заполняется орбиталь с меньшим значением . При одинаковой сумме раньше заполняется орбиталь с меньшим значением 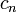 . . |
Правило n+l предложено в 1936 г. немецким физиком Э. Маделунгом; в 1951 г. было вновь сформулировано В. М. Клечковским.
Распределение электронов по орбиталям в водородоподобных и многоэлектронных атомах
По мере увеличения суммарного числа электронов в атомах атомные орбитали заселяются таким образом, что появление электронов на орбитали с более высокой энергией зависит только от главного квантового числа n и не зависит от всех остальных квантовых чисел, в том числе и от l. Физически это означает, что в водородоподобном атоме орбитальная энергия электрона определяется только пространственной удаленностью зарядовой плотности электрона от ядра и не зависит от особенностей его движения в поле ядра. Поэтому энергетическая последовательность орбиталей в водородоподобном атоме выглядит просто:
Здесь орбитальная энергия электрона повышается только по мере увеличения главного квантового числа и не меняется при увеличении орбитального квантового числа l; состояния с различными значениями l, но с одним и тем же значением n энергетически эквивалентны, то есть соответствующие атомные орбитали обладают одинаковой энергией и оказываются энергетически вырожденными.
В многоэлектронных атомах в результате эффекта межэлектронных взаимодействий происходит энергетическое расщепление орбиталей различного типа, но с одним и тем же значением главного квантового числа. Если бы это расщепление было небольшим и меньшим расщепления по энергии атомных орбиталей под воздействием изменения главного квантового числа n, то энергетическая последовательность атомных орбиталей выглядела бы так:
В действительности же расщепление по l, начиная с n≥З, оказывается большим, чем расщепление по n. Сложный характер явления межэлектронных взаимодействий предопределяет сильную зависимость орбитальной энергии каждого электрона уже не только от пространственной удаленности его зарядовой плотности от ядра, но и от формы его движения в поле ядра. Именно межэлектронное взаимодействие приводит к резко усложнённой энергетической последовательности заселяющихся электронами атомных орбиталей. Итак, в реальных многоэлектронных атомах картина энергетического распределения орбиталей оказывается очень сложной. Строгая квантовомеханическая теория электронного строения атомов и экспериментальная спектроскопия обнаруживают энергетическую последовательность атомных орбиталей в следующем виде:
Просмотров: 14027
|
|