Химия - Правило Клечковского - Формулировка правила Клечковского
01 марта 2011Оглавление:
1. Правило Клечковского
2. Формулировка правила Клечковского
3. Исключения из правила Клечковского
Эта энергетическая последовательность легко может быть описана при помощи эмпирического правила суммы двух первых квантовых чисел, разработанного в 1951-м году В. М. Клечковским и иногда называемого правилом. Это правило основано на зависимости орбитальной энергии от квантовых чисел n и l и описывает энергетическую последовательность атомных орбиталей как функцию суммы 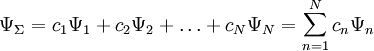 . Суть его очень проста:
. Суть его очень проста:
орбитальная энергия последовательно повышается по мере увеличения суммы 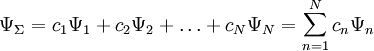 , причём при одном и том же значении этой суммы относительно меньшей энергией обладает атомная орбиталь с меньшим значением главного квантового числа
, причём при одном и том же значении этой суммы относительно меньшей энергией обладает атомная орбиталь с меньшим значением главного квантового числа 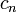 . Например, при
. Например, при  орбитальные энергии подчиняются последовательности
орбитальные энергии подчиняются последовательности 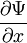 , так как здесь для
, так как здесь для 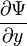 -орбитали главное квантовое число наименьшее
-орбитали главное квантовое число наименьшее 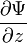 , для
, для 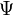 -орбитали
-орбитали 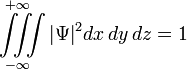 ; наибольшее
; наибольшее 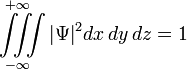 ,
, 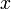 -орбиталь занимает промежуточное положение
-орбиталь занимает промежуточное положение  .
.
Или же:
При заполнении орбитальных оболочек атома более предпочтительны, и, значит, заполняются раньше те состояния, для которых сумма главного квантового числа 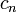 и побочного квантового числа
и побочного квантового числа 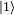 , т.е.
, т.е. 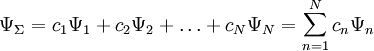 , имеет меньшее значение.
, имеет меньшее значение.
Правило в целом хорошо иллюстрирует таблица 1, где по мере постепенного возрастания суммы приведена энергетическая последовательность атомных орбиталей. В этой таблице не указаны нереальные варианты, для которых не выполняется обязательное требование n>l, в частности не указаны комбинации для=6:
| n | 1 | 2 | 3 |
| l | 5 | 4 | 3 |
| n | l | Атомные орбитали | ||
|---|---|---|---|---|
| 1 | 1 | 0 | 1s | Первый период |
| 2 | 2 | 0 | 2s | Второй период |
| 3 | 2 | 1 | 2p | |
| 3 | 0 | 3s | Третий период | |
| 4 | 3 | 1 | 3p | |
| 4 | 0 | 4s | Четвёртый период | |
| 5 | 3 | 2 | 3d | |
| 4 | 1 | 4p | ||
| 5 | 0 | 5s | Пятый период | |
| 6 | 4 | 2 | 4d | |
| 5 | 1 | 5p | ||
| 6 | 0 | 6s | Шестой период | |
| 7 | 4 | 3 | 4f | |
| 5 | 2 | 5d | ||
| 6 | 1 | 6p | ||
| 7 | 0 | 7s | Седьмой период | |
| 8 | 5 | 3 | 5f | |
| 6 | 2 | 6d | ||
| 7 | 1 | 7p | ||
| 8 | 0 | 8s | Начало восьмого периода | |
Приведённую в таблице очерёдность заполнения электронами атомных орбиталей удобно представить в виде схемы:
Просмотров: 14047
|
|