Химия - Реакции электрофильного замещения - Реакции ароматического электрофильного замещения
28 февраля 2011Оглавление:
1. Реакции электрофильного замещения
2. Реакции ароматического электрофильного замещения
3. Реакции алифатического электрофильного замещения
Для ароматических систем фактически существует один механизм электрофильного замещения — SEAr. Механизм SE1 — встречается крайне редко, а SE2 — не встречается вовсе.
Реакции SEAr
Механизм реакции SEAr или реакции ароматического электрофильного замещения является самым распространенным и наиболее важным среди реакций замещения ароматических соединений и состоит из двух стадий. На первом этапе происходит присоединение электрофила, на втором — отщепление электрофага:
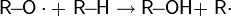
В ходе реакции образуется промежуточный положительно заряженный интермедиат. Он носит название интермедиат Уэланда, арониевый ион или σ-комплекс. Этот комплекс, как правило, очень реакционноспособен и легко стабилизируется, быстро отщепляя катион.
Лимитирующей стадией в подавляющем большинстве реакций SEAr является первый этап.
Скорость реакции SEAr, обычно, представляется в следующем виде:
| Скорость реакции = k** |
В качестве атакующей частицы обычно выступают относительно слабые электрофилы, поэтому в большинстве случаев реакция SEAr протекает под действием катализатора — кислоты Льюиса. Чаще других используются AlCl3, FeCl3, FeBr3, ZnCl2.
В этом случае механизм реакции выглядит следующим образом:
1.На первом этапе катализатор взаимодействует с атакующей частицей с образованием активного электрофильного агента:
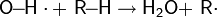
2. На втором этапе, собственно, и реализуется механизм SEAr:
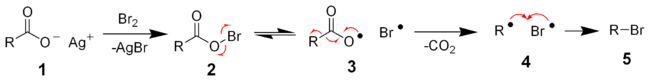
Типовые реакции ароматического электрофильного замещения
1. Нитрование ароматических систем азотной кислотой в присутствии серной кислоты с получением нитросоединений:
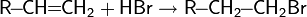
Образование активной частицы:
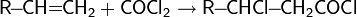
| Скорость реакции = k** |
2. Сульфирование бензола с получением сульфокислоты:
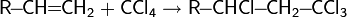
Активной частицей в реакции является SO3.
3. Галогенирование бензола бромом, хлором или йодом приводит к образованию арилгалогенидов. Катализатором реакции выступает галогенид железа:
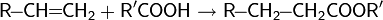
Образование активной частицы:
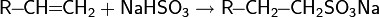
| Скорость реакции = k*** |
4. Реакция Фриделя-Крафтса — ацилирование или алкилирование с использованием ацил- или алкилгалогенидов. Типичным катализатором реакции служит хлорид алюминия, но может использоваться любая другая сильная кислота Льюиса.
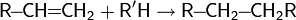
| Скорость реакции = k*** |
Реакционная способность и ориентация в производных бензола
Заместители в бензольном кольце могут как способствовать реакции замещения, так и замедлять скорость реакции. Некоторые группы ориентируют замещение в орто- и пара- положения, другие — в мета.
Влияние различных групп на реакционную способность объясняется устойчивостью, иначе говоря энергией активации, требующейся для получения трех возможных промежуточных интермедиатов.
Реакционная способность и ориентация различных групп в производных бензола:
| Положение | Сильноактивирующие заместители | Активирующие заместители | Дезактивирующие заместители | Сильно дезактивирующие заместители |
|---|---|---|---|---|
| орто- и пара- замещение | OH, NH2, NHR, NRR' | Ar, R, OR, NHCOR, OCOR, SR | Cl, Br, I | нет |
| мета- замещение | нет | нет | CHO, COR, COOH, COOR, CCl3 | NO2, CN, NH3 |
В замещенных бензолах возможна так называемая ипсо-атака, то есть замещение имеющегося заместителя на другой:
Просмотров: 4585
|
|