Химия - Соли - Методы получения
01 марта 2011Оглавление:
1. Соли
2. Названия солей
3. Методы получения
4. Применение солей
5. Галерея изображения солей
Существуют различные методы получения солей:
- Взаимодействие кислот с металлами, основными и амфотерными оксидами / гидроксидами:



- Взаимодействие кислотных оксидов c щелочами, основными и амфотерными оксидами / гидроксидами:
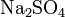
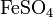
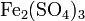
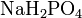
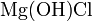
- Взаимодействие солей c кислотами, другими солями:
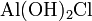
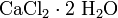
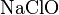
- Взаимодействие простых веществ:
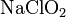
- Взаимодействие оснований с неметаллами, например с галогенами:
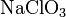
Химические свойства
Химические свойства определяются свойствами катионов и анионов, входящих в их состав.
- Соли взаимодействуют с кислотами и основаниями, если в результате реакции получается продукт, который выходит из сферы реакции:
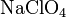
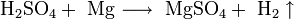
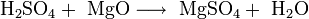
- Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряде активности металлов:
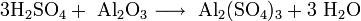
- Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции; в том числе эти реакции могут проходить с изменением степеней окисления атомов реагентов:
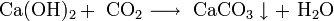
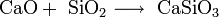
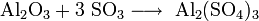
- Некоторые соли разлагаются при нагревании:
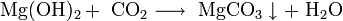
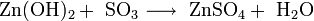
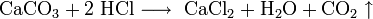
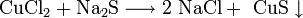
Просмотров: 15847
|
|