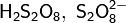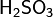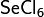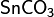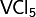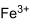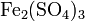Химия - Сульфат железа(III) - Получение
15 июля 2011Оглавление:
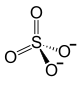
1. Сульфат железа(III)
2. Нахождение в природе
3. Получение
4. Химические свойства
В промышленности сульфат железа получают прокаливанием пирита или марказита с NaCl на воздухе:
или растворяют оксид железа в серной кислоте:
В лабораторной практике сульфат железа можно получить из гидроокиси железа:
Препарат той же чистоты можно получить окислением сульфата железа азотной кислотой:
также окисление можно провести кислородом или оксидом серы:
Концентрированные серная и азотная кислоты окисляют сульфид железа до сульфата железа:
Дисульфид железа можно окислить концентрированной серной кислотой:
Сульфат-аммоний железа также можно окислить дихроматом калия. Вследствие данной реакции выделятся сразу четыре сульфата — железа, хрома, аммиака и калия, и вода:
Сульфат железа можно получить как один из продуктов термического разложения сульфата железа:
Ферраты с разбавленной серной кислотой восстанавливаются до сульфата железа:
Нагрев пентагидрат до температуры 70—175 °C получим безводный сульфат железа:
Сульфат железа можно окислить таким экзотическим окислителем, как оксид ксенона:
Просмотров: 8875
|
|