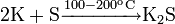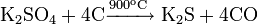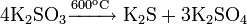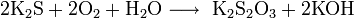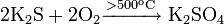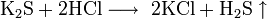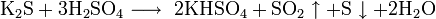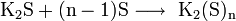Химия - Сульфид кальция
28 февраля 2011Оглавление:
1. Сульфид кальция
2. Применение
Получение
Известен минерал Ольдгамит состоящий из сульфида кальция с примесями магния, натрия, железа, меди. Кристаллы бледно-коричневого цвета, переходящего в темно-коричневый.
Прямой синтез из элементов:
Реакцией гидрида кальция в сероводороде:
Из карбоната кальция:
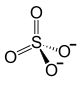
Восстановлением сульфата кальция:
Физические свойства
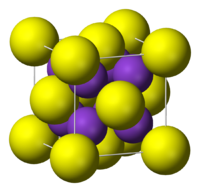
Белые кристаллы, кубическая гранецентрированная решётка типа NaCl. При плавлении разлагается. В кристалле каждый ион S ион окружен октаэдром, состоящим из шести ионов Са, в то время как каждый ион Са окружен шестью S ионами.
Малорастворим в холодной воде, кристаллогидратов не образует. Как и многие другие сульфиды, сульфид кальция в присутствии воды подвергается гидролизу и имеет запах сероводорода.
Химические свойства
При нагревании разлагается на компоненты:
В кипящей воде полностью гидролизуется:
Разбавленные кислоты вытесняют сероводород из соли:
Концентрированные кислоты-окислители окисляют сероводород:
Сероводород слабая кислота и может вытесняться из солей даже углекислым газом:
При избытке сероводорода образуются гидросульфиды:
Как и все сульфиды, сульфид кальция окисляется кислородом:
Просмотров: 3760
|
|