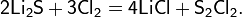Химия - Сульфид лития - Полисульфиды лития
28 февраля 2011Оглавление:
1. Сульфид лития
2. Получение
3. Полисульфиды лития
4. Опасность для здоровья
Для лития, в отличие от других щелочных металлов, полисульфиды не являются характерными соединениями и их получение требует особых условий.
Наиболее изучены:
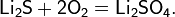 — дисульфид лития, жёлтый порошок, получаемый кипячением спиртового раствора гидросульфида лития с избытком серы в токе водорода:
— дисульфид лития, жёлтый порошок, получаемый кипячением спиртового раствора гидросульфида лития с избытком серы в токе водорода:
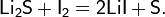 — тетрасульфид лития, неустойчивое вещество, получаемое реакцией лития с серой в жидком аммиаке:
— тетрасульфид лития, неустойчивое вещество, получаемое реакцией лития с серой в жидком аммиаке:
 |
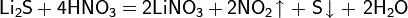 |
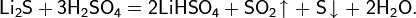 |
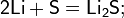 |
Применение
Сульфид лития входит в состав анодов и твёрдого электролита для литиевых элементов питания. Также используется как депиляционный агент в косметических средствах.
Может использоваться как компонент в производства стёкол с высокой ионной проводимостью.
В современной органической химии сульфид лития иногда используется в качестве сульфидирующего агента, например, в следующей реакции:
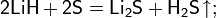 .
.
Также имеются данные об использовании этого вещества в качестве катализатора при защите гидроксильных групп через получение триметилсилилового эфира.
Просмотров: 5564
|
|