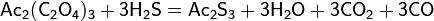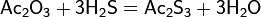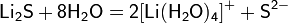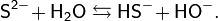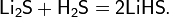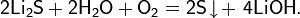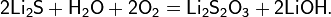Химия - Сульфид лития - Получение
28 февраля 2011Оглавление:
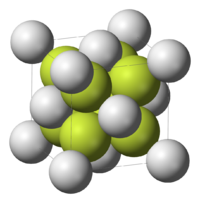
1. Сульфид лития
2. Получение
3. Полисульфиды лития
4. Опасность для здоровья
Одна из потенциальных проблем при получении сульфида лития заключается в легкости его окисления, особенно в присутствии воды. Кроме того, вследствие гидролиза препаративные методы, основанные на реакциях обмена в водных растворах, обычно непригодны.
Так как сульфид лития не встречается в природе в виде минерального сырья, существуют следующие промышленные способы его получения:
- реакция металлического лития с элементарной серой при нагревании выше 130 °C:
- взаимодействие гидрида лития с элементарной серой при температуре 300-350 °C:
- прокаливание оксида или карбоната лития в токе сухого сероводорода при температуре 900-1000 °C:
- восстановление сульфата лития коксом или водородом при высоких температурах:
Среди прочих возможных методов производства можно отметить:
- взаимодействие гидроксида лития с газообразной серой при температуре до 445 °C:
- взаимодействие гидроксида лития с сероводородом в среде апротонного органического растворителя:
Просмотров: 5562
|
|