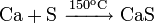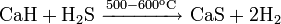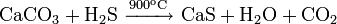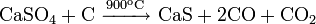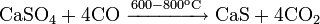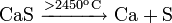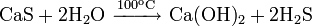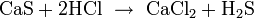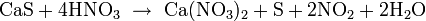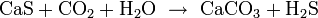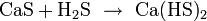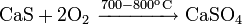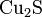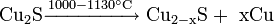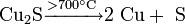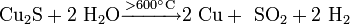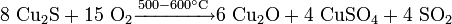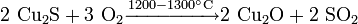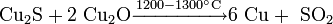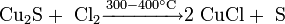Химия - Сульфид меди(I) - Химические свойства
15 июля 2011Оглавление:
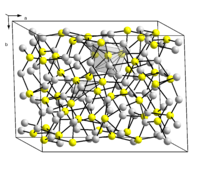
1. Сульфид меди(I)
2. Химические свойства
3. Применение
Реакции при высоких температурах
При атмосферном давлении в инертной атмосфере:
В вакууме:
С водяным паром:
С кислородом:
С хлором:
С сульфидом железа и серой:
Реакции в растворах
Сульфид меди не реагирует с соляной кислотой.
Растворяется в горячей концентрированной азотной кислоте, концентрированном растворе цианида калия:
Медленно растворяется в холодной концентрированной азотной кислоте, горячей концентрированной серной кислоте, концентрированном растворе аммиака:
Восстанавливает Fe до Fe:
Получение
Сульфид меди может быть получен одним из следующих способов.
Нагреванием металлической меди с серой в вакууме:
Нагреванием металлической меди в токе диоксида серы:
Термическим разложением сульфида меди:
Нагреванием сульфида меди в токе водорода:
Нагреванием оксида меди с серой:
Монокристаллы сульфида меди получают при помощи зонной плавки.
Просмотров: 5564
|
|