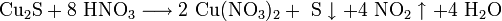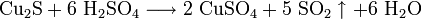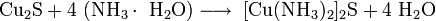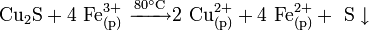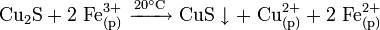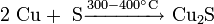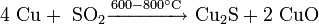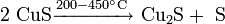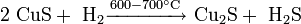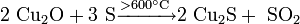Химия - Сульфид молибдена(IV) - Получение
02 июля 2011Оглавление:
1. Сульфид молибдена(IV)
2. Получение
3. Использование в качестве смазки
4. Использование в нефтехимии
В природе дисульфид молибдена встречается в виде минерала — молибденита. Также известна природная аморфная форма — жордизит, которая встречается значительно реже. Руды молибденита всегда содержат большое количество примесей, поэтому их обогащают с помощью флотации, получая в конце процесса относительно чистый MoS2 — основной исходный продукт для дальнейшего получения молибдена .
В лабораторной практике дисульфид молибдена может быть получен непосредственно из элементов:
Взаимодействием молибдена или его диоксида с сероводородом:
Химические свойства
Дисульфид молибдена не растворяется в воде, не реагирует с разбавленными кислотами и щелочами.
При нагревании без доступа воздуха MoS2 разлагается в несколько стадий:
При нагревании на воздухе дисульфид молибдена окисляется:
Перегретый пар также взаимодействует с дисульфидом молибдена:
Концентрированные неокисляющие кислоты разлагают MoS2 до диоксида:
Концентрированные, горячие окисляющие кислоты окисляют MoS2 до триоксида:
Водород восстанавливает дисульфид молибдена:
При хлорировании дисульфида молибдена при повышенных температурах получается пентахлорид молибдена:
Дисульфид молибдена реагирует с литием с образованием интеркаляционных соединений:
При реакции с n-бутиллитием получается соединение с формулой LiMoS2.
При сплавлении с сульфидами щелочных металлов образует тиосоли:
Просмотров: 4424
|
|