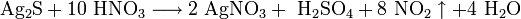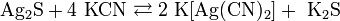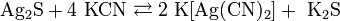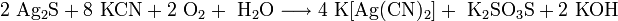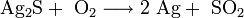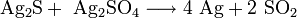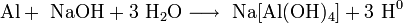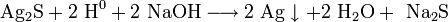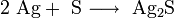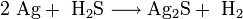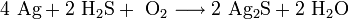Химия - Сульфид серебра - Химические свойства
01 марта 2011Оглавление:
1. Сульфид серебра
2. Химические свойства
3. Применение
Переведение в раствор
Сульфид серебра не реагирует с кислотами при комнатной температуре.
При нагревании растворяется в концентрированной азотной кислоте:
За счет комплексообразования растворяется при комнатной температуре в концентрированных растворах цианидов:
Восстановление серебра
Следующие реакции сульфида серебра приводят к восстановлению металлического серебра:
Нагревание в токе кислорода до 500—600 °C:
Нагревание с сульфатом серебра выше 300 °C:
Восстановление с помощью алюминия в концентрированном горячем растворе щёлочи:
алюминий растворяется в щёлочи с образованием атомарного водорода:
атомарный водород восстанавливает серебро из сульфида:
Получение
Сульфид серебра может быть получен следующими способами.
Прямым синтезом из простых веществ при температуре выше 200 °C:
Окислением металлического серебра сероводородом в присутствии влаги или кислорода воздуха:
Осаждением из растворов с помощью реакций ионного обмена, например:
Просмотров: 6659
|
|