Химия - Теории кислот и оснований - Электронная теория Льюиса
01 марта 2011Оглавление:
1. Теории кислот и оснований
2. Теория электролитической диссоциации Аррениуса-Оствальда
3. Протонная теория Брёнстеда-Лоури
4. Электронная теория Льюиса
5. Общая теория Усановича
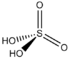
и трифторида бора
В теории Льюиса на основе электронных представлений было ещё более расширено понятие кислоты и основания. Кислота Льюиса — молекула или ион, имеющие вакантные электронные орбитали, вследствие чего они способно принимать электронные пары, например ионы водорода – протоны, ионы металлов, оксиды некоторых неметаллов, ряд солей, а также такие вещества как BF3, Al2O3. Кислоты Льюиса, не содержащие ионов водорода, называются апротонными. Протонные кислоты рассматриваются как частный случай класса кислот. Основание Льюиса — это молекула или ион, способные быть донором электронных пар: все анионы, аммиак и амины, вода, спирты, галогены. Примеры химических реакций между кислотами и основаниями Льюиса:
- AlCl3 + Cl → AlCl4
- BF3 + F → BF4
- PCl5 + Cl → PCl6.
Просмотров: 18555
|
|