Химия - Теория отталкивания электронных пар - Развитие теории ОЭПВО и примеры
28 февраля 2011Оглавление:
1. Теория отталкивания электронных пар
2. Развитие теории ОЭПВО и примеры
3. Недостатки теории ОЭПВО и отклонения от ее предсказаний
4. Основной источник
- Неподеленная электронная пара занимает больший объем, чем пара электронов на орбитали, участвующей в образовании ординарной связи. Сила отталкивания электронных пар в данной валентной оболочке понижается в следующем порядке: неподеленная пара — неподеленная пара > неподеленная пара — связывающая пара > связывающая пара — связывающая пара.
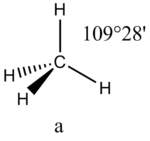
Это допущение вытекает из таких простых аргументов, как то, что неподеленная электронная пара находится в поле только одного положительного атомного остова и, следовательно, более диффузна, чем связывающая электронная пара, испытывающая сжатие полем зарядов двух атомных остовов. Отсюда следует вывод, что в серии изоэлектронных молекул неподеленная пара, заменяя связывающую электронную пару, стремится занять больше пространства вокруг атома. Это уменьшает валентные углы между связями, например, в ряду
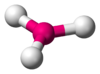

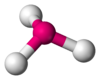
Аналогичное объяснение имеют отклонения от полностью симметричной ориентации связей в молекуле типа АХ5Е, АХ4Е, АХ3Е2.
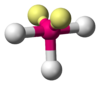
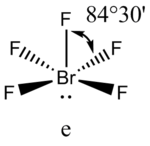
Поскольку отталкивания электронных пар типа Е — X доминируют по сравнению с отталкиваниями X—X, валентные углы ХАХ несколько сжаты:
:
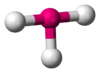
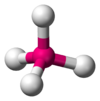
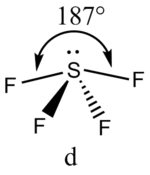
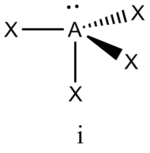
В прямой связи с данными об эффективных объемах связывающих и неподеленных электронных пар находится такое важное следствие, как положение о том, что в молекулах типа АХ4Е, АХ3Е2, АХ2Е3, геометрическая форма которых производится от структуры тригональной бипирамиды, электронные пары всегда занимают экваториальные положения

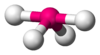
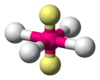
Это объясняется тем, что в структуре h имеются только два невыгодных Е—Х-взаимодействия электронных пар, когда их оси составляют угол 90°. В структуре i таких невыгодных взаимодействий три. - Объем электронной пары, участвующей в образовании связи, уменьшается с увеличением электроотрицательности лиганда.
Более электроотрицательный лиганд сильнее притягивает общее электронное облако связывающей пары, что можно представить как дополнительное сжатие этого облака. Данная электронная пара будет более удалена от центрального атома и испытывает меньшее отталкивание со стороны других соседних электронных пар. Все это поведет к тому, что валентные углы, составляемые связями центрального атома с наиболее электроотрицательными лигандами, должны иметь наименьшие значения.
Эффект влияния изменения электроотрицательности лигандов на валентные углы связей иллюстрируется сравнением молекул NH3 и NF3. Большая электроотрицательность фтора уменьшает размеры пары на связи N—F, в результате углы FNF составляют всего 102°, что на 5° меньше, чем углы HNH в аммиаке. Такая же тенденция наблюдается в ряду РI3, РВr3, РСl3, РF3.
Интересный пример — молекула2РF3.
Валентные углы в этой молекуле уменьшаются в порядке СРС > СРF > FРF, соответствующем порядку возрастания электроотрицательности лигандов.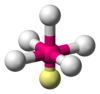
Следует отметить, что, если рассматривать неподеленную электронную пару как некий воображаемый лиганд с предельно малой электроотрицательностью, правила 1 и 2 легко обобщаются. - Две электронные пары двойной связи или три электронные пары тройной связи занимают больший объем, чем электронная пара ординарной связи.
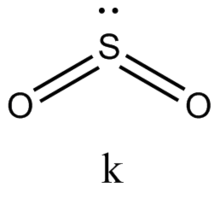
Это правило является основным при рассмотрении геометрической структуры молекул, содержащих кратные связи. Как и для остальных молекул, определение конфигурации связей центрального атома основывается на выделении электронных пар σ-cвязей и неподеленных электронов. Электроны π-связей на этой стадии не учитываются. Так, например, чтобы определить форму молекулы S02, необходимо учесть, что из шести электронов в валентной оболочке серы два расходуются на образование двух π-связей. Из оставшихся четырех два образуют с неподеленными электронами кислородных атомов а-связи, а два остаются в виде неподеленной пары. Таким образом, необходимо учесть относительную ориентацию облаков трех электронных пар, что в согласии с данными табл. 4 ведет к угловой конфигурации.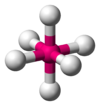
В табл. 5 представлены данные о геометрической структуре широкого ряда молекул непереходных элементов с кратными связями. Так как кратная связь содержит более чем одну электронную пару, ее электронное облако занимает большее пространство, чем электронная пара ординарной связи. Размер электронного облака двойной связи по сравнению с размером орбитали неподеленной электронной пары недостаточно определен. Обычно их размеры принимают равными. Больший размер кратной связи виден из примеров молекул типа Х2СО и Х2С=СН2, пирамидальных молекул типа Х2SO, тетраэдрических молекул типа РОХ3. Из табл. 5 видно, что угол ХСХ всегда меньше 120°, угол ХS0 больше угла ХSХ.
Таблица 4. Геометрическая структура молекул непереходных элементов, содержащих кратные связи.
| Общее число электронных пар σ-орбиталей и несвязывающих орбиталей |
Число σ-связей | Число неподеленных пар | Конфигурация связей | Примеры |
|---|---|---|---|---|
| 2 | 2 | 0 | Линейная | |
| 3 |
|
|
|
  |
| 4 |
|
|
|
 , ,  |
| 5 |
|
|
|
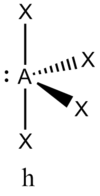  |
| 6 | 6 | 0 | Октаэдрическая | 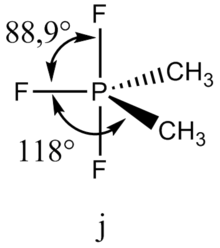 |
- Важно подчеркнуть, что выводы теории ОЭПВО о геометрическом строении молекул легко экстраполируются на более сложные молекулы и ионы, чем рассмотренные в табл. 2-5. В каждом случае необходимо выделить фрагмент, содержащий центральный атом, координирующий около себя другие атомы или их группировки, и установить число и тип окружающих данный атом электронных пар. Таким образом, нетрудно определить, например, структуру молекулы Р4. Каждый атом фосфора в ней имеет три соседа и, кроме того, сохраняет одну неподеленную электронную пару. Следовательно, должна реализоваться тетраэдрическая конфигурация осей электронных пар, отвечающая молекулярной структуре l:
| Молекула | Угол, град | Молекула | Угол, град | ||
|---|---|---|---|---|---|
| XCX | CXO | XCX | XCC | ||
| F2CO | 108,0 | 126 | H2CH=CH2 | 116,8 | 122 |
| CH3COF | 110 | 128; 122 | H2C=CHF | 115,4 | 123,3; 120,9 |
| Cl2CO | 111,3 | 124,3 | H2C=CF2 | 109,3 | 125,3 |
| H2CO | 115,8 | 122,1 | H2C=CCl2 | 114 | 123 |
| 2CO | 118 | 121 | F2C=CH2 | 110 | 125 |
| 2CS | 116 | 122 | F2C=CFCl | 114 | 123 |
| Молекула | XSX | XSO | Молекула | XPX | XPO |
| F2SO | 92,8 | 106,8 | POF3 | 101,3 | 113 |
| Br2SO | 96 | 108 | POCl3 | 103,3 | 112 |
| 2SO | 100 | 107 | POBr3 | 108 | 110 |
| 2SO | 97,3 | 106,2 | PSF3 | 100,3 | 113,8 |
- Таким же образом приходим к пирамидальной конфигурации связей атома селена в полимерном диоксиде селенаn, угловой структуре полимерной цепи кристалла НF. Положения теории ОЭПВО полезны при определении строения не только стабильных молекул и ионов, но также для описания относительной ориентации групп в метастабильных комплексах и даже переходных состояниях реакций присоединения, замещения. Так, например, в полном согласии с данными строгих расчетов предсказывается тригонально-бипирамидальное строение переходного состояния в реакции бимолекулярного замещения на sp-углеродном центре:

Действительно, пять электронных пар, окружающих центральный атом углерода в переходном состоянии реакции замещения, обусловливает его структуру p.
Просмотров: 10014
|
|