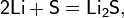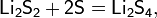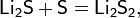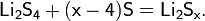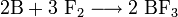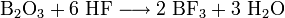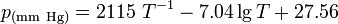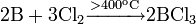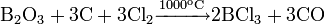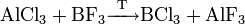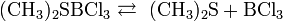Химия - Трихлорид бора - Получение
01 марта 2011Оглавление:
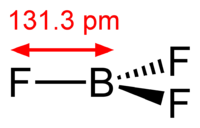
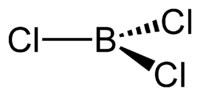
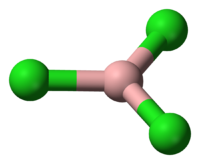
1. Трихлорид бора
2. Получение
3. Применение
Трихлорид бора можно синтезировать из элементов:
В промышленности вместо чистого бора используют его сплавы, например ферробор.
Также в промышленности также используют метод хлорирования при температуре ~1000 °C смеси оксида бора и кокса:
Трихлорид алюминия и трифторид бора могут обмениваться галогенами:
В лабораторной практике трихлорид бора получают разложением его аддуктов, например, BCl3S2, которые удобны в работе, т.к. являются твёрдыми веществами:
Химические свойства
Полностью гидролизуется водой с выделением большого количества тепла:
Реагирует с разбавленными и концентрированными щелочами:
Восстанавливается водородом до бора или борана:
Горит в кислороде:
Фтор вытесняет хлор из соединения:
Трихлорид бора является кислотой Льюиса, которая образует аддукты с третичными аминами, фосфинами, эфирами, тиоэфирами и галогенид-ионами:
Реагирует с оловоорганическими соединениями:
При пропускании через трихлорид бора электрической искры получаются низшие хлориды бора B2Cl6, B4Cl4, B8Cl8:
Реагирует со спиртами с образованием эфиров-боратов:
При нагревании реагирует с борным ангидридом с образованием оксихлорида бора:
Металлы могут восстанавливать трихлорид бора до бора или образовывать бориды:
Просмотров: 4035
|
|