Химия - Уравнение Гаммета
01 марта 2011Уравнение Гаммета — выражение для линейной зависимости свободных энергий, фундаментального принципа физической органической химии, утверждающее, что количественные изменения реакционной способности в одной реакции из двух схожих коррелируют с количественными изменениями реакционной способности в другой.
Открыто в 1935 году Л. Гамметом и Г. Буркхардом.
В аналитическом виде оно записывается следующим образом:
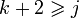 ,
,где k — константы скоростей двух реакций для данного заместителя, стандартной и j-й; ρ — параметр чувствительности реакции к смене заместителя; σ — параметр заместителя.
Уравнение Гаммета демонстрирует то, что заместители оказывают пропорциональный вклад на ход реакций, в которых проявляются лишь их индуктивный и мезомерный эффекты, но не проявляется стерическое и прочие специфические взаимодействия. Кроме того, параметры заместителей и реакции допускают возможность их сравнения. Так, определение параметра ρ является частым приёмом при изучении механизма реакций.
Существует ряд шкал σ-параметров с учётом мезомерного эффекта и без.
Уравнение Гаммета лишь частично применимо для процессов, в которых есть существенный вклад резонансного влияния заместителя на реакционный центр соединения. В последнем случае используют уточненное уравнение Гаммета-Тафта.
Просмотров: 2149
|
|