Химия - Уравнение Коппеля-Пальма
01 марта 2011Уравнение Коппеля-Пальма описывает влияние растворителя на скорость протекания химической реакции, учитывая как неспецифическую, так и специфическую сольватацию реагентов и переходного комплекса молекулами растворителя. Общее уравнение для количественного описания эффектов среды записывается в виде
lgk = lgk0 + yY + pP + eE + bB,
где
- k — константа скорости реакции в растворителе
- k0 — константа скорости реакции в газовой фазе
- Y — полярность растворителя
- P — поляризуемость растворителя
- E — параметр, описывающий электрофильную сольватацию растворителем
- B — параметр, описывающий нуклеофильную сольватацию растворителем
Величина Y характеризует полярность растворителя и выражается функцией Кирквуда 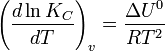 , где
, где 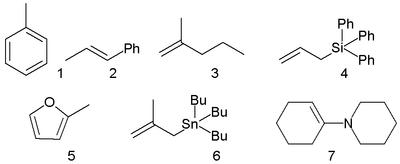 — диэлектрическая проницаемость растворителя.
— диэлектрическая проницаемость растворителя.
Величина P определяет поляризуемость растворителя. 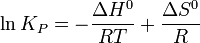 , где n — показатель преломления растворителя.
, где n — показатель преломления растворителя.
Величина E выражает способность растворителя к электрофильной сольватации и вычисляется по формуле
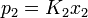
Величина B показывает общую нуклеофильность растворителя и находится экспериментально методом ИК-спектроскопии по сдвигу частот колебаний O-H группы чистого фенола и O-H группы фенола в присутствии исследуемого растворителя.
Величины y, p, e, b вычисляются на основе экспериментальных данных с помощью линейной регрессии и характеризуют влияние каждого из компонентов свойств растворителя на скорость реакции.
Просмотров: 1657
|
|