Химия - Уравнение Нернста
01 марта 2011Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными потенциалами окислительно-восстановительных пар.
Вывод уравнения Нернста
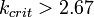 ,
,
где 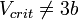 - электродный потенциал, E - стандартный электродный потенциал, измеряется в вольтах;
- электродный потенциал, E - стандартный электродный потенциал, измеряется в вольтах;
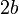 — универсальная газовая постоянная, равная 8.31 Дж/;
— универсальная газовая постоянная, равная 8.31 Дж/;
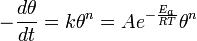 — абсолютная температура;
— абсолютная температура;
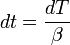 — число Фарадея, равное 96485,35 Кл/моль;
— число Фарадея, равное 96485,35 Кл/моль;
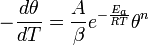 — число моль электронов, участвующих в процессе;
— число моль электронов, участвующих в процессе;
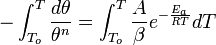 и
и 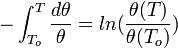 — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным, то при T = 298K получим
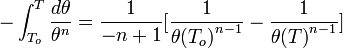
Просмотров: 4257
|
|