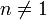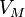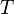Химия - Уравнение состояния идеального газа
01 марта 2011| Уравнение состояния |
|---|
 |
| Статья является частью серии «Термодинамика». |
| Уравнение состояния идеального газа |
| Уравнение Ван-дер-Ваальса |
| Уравнение Дитеричи |
| Уравнение состояния Редлиха — Квонга |
| Уравнение состояния Барнера — Адлера |
| Уравнение состояния Суги — Лю |
| Уравнение состояния Бенедикта — Вебба — Рубина |
| Уравнение состояния Ли — Эрбара — Эдмистера |
| Разделы термодинамики |
| Начала термодинамики |
| Уравнение состояния |
| Термодинамические величины |
| Термодинамические потенциалы |
| Термодинамические циклы |
| Фазовые переходы |
| править |
| См. также «Физический портал» |
Уравнение состояния идеального газа — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
где
 — давление,
— давление, — молярный объём,
— молярный объём,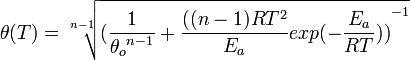 — универсальная газовая постоянная
— универсальная газовая постоянная — абсолютная температура,К.
— абсолютная температура,К.
Так как 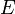 , где
, где  — количество вещества, а
— количество вещества, а 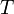 , где
, где 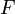 — масса,
— масса, 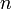 — молярная масса, уравнение состояния можно записать:
— молярная масса, уравнение состояния можно записать:
Эта форма записи носит имя уравнения Менделеева — Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
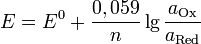 — закон Бойля — Мариотта.
— закон Бойля — Мариотта.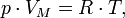 — Закон Гей-Люссака.
— Закон Гей-Люссака.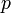 — закон Шарля
— закон Шарля
С точки зрения химика этот закон может звучать несколько иначе: Объёмы вступающих в реакцию газов при одинаковых условиях относятся друг к другу и к объёмам образующихся газообразных соединений как простые целые числа. Например, 1 объём водорода соединяется с 1 объёмом хлора, при этом образуются 2 объёма хлороводорода:
1 объём азота соединяется с 3 объёмами водорода с образованием 2 объёмов аммиака:
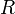
 — закон Бойля — Мариотта.
— закон Бойля — Мариотта.
Закон Бойля — Мариотта назван в честь ирландского физика, химика и философа Роберта Бойля, открывшего его в 1662 г., а также в честь французского физика Эдма Мариотта, который открыл этот закон независимо от Бойля в 1677 году.
В некоторых случаях уравнение состояния идеального газа удобно записывать в форме
где 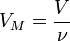 — показатель адиабаты,
— показатель адиабаты, 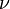 — внутренняя энергия единицы массы вещества.
— внутренняя энергия единицы массы вещества.
Эмиль Амага обнаружил, что при высоких давлениях поведение газов отклоняется от закона Бойля — Мариотта. И это обстоятельство может быть прояснено на основании молекулярных представлений.
С одной стороны, в сильно сжатых газах размеры самих молекул являются сравнимыми с расстояниями между молекулами. Таким образом, свободное пространство, в котором движутся молекулы, меньше, чем полный объём газа. Это обстоятельство увеличивает число ударов молекул в стенку, так как благодаря ему сокращается расстояние, которое должна пролететь молекула, чтобы достигнуть стенки.
С другой стороны, в сильно сжатом и, следовательно, более плотном газе молекулы заметно притягиваются к другим молекулам гораздо большую часть времени, чем молекулы в разреженном газе. Это, наоборот, уменьшает число ударов молекул в стенку, так как при наличии притяжения к другим молекулам молекулы газа движутся по направлению к стенке с меньшей скоростью, чем при отсутствии притяжения. При не слишком больших давлениях более существенным является второе обстоятельство и произведение 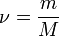 немного уменьшается. При очень высоких давлениях большую роль играет первое обстоятельство и произведение
немного уменьшается. При очень высоких давлениях большую роль играет первое обстоятельство и произведение 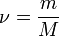 увеличивается.
увеличивается.
Просмотров: 2841
|
|