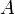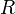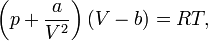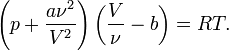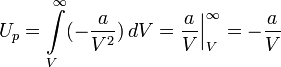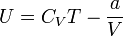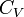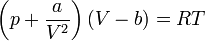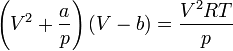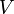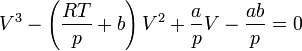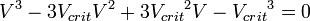Химия - Уравнение Ван-дер-Ваальса - Критические параметры
01 марта 2011Оглавление:
1. Уравнение Ван-дер-Ваальса
2. Уравнение состояния
3. Критические параметры
4. Недостатки уравнения Ван-дер-Ваальса
Критическими параметрами газа называются значения его макропараметров в критической точке, т.е. в таком состоянии, когда жидкая и газообразная фазы вещества неразличимы. Найдем эти параметры для газа Ван-дер-Ваальса, для чего преобразуем уравнение состояния:
Мы получили уравнение третьей степени относительно 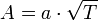 .
.
В критической точке все три корня уравнения сливаются в один, поэтому предыдущее уравнение эквивалентно следующему:
Приравняв коэффициенты при соответствующих степенях 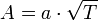 , получим равенства:
, получим равенства:
Из них вычислим значения критических параметров...
...и критического коэффициента:
Приведённые параметры
Приведённые параметры определяются как отношения
Если подставить в уравнение Ван-дер-Ваальса 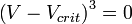 получится приведённое уравнение состояния.
получится приведённое уравнение состояния.
Стоит отметить, что если вещества обладают двумя одинаковыми приведёнными параметрами из трёх, то и третьи приведённые параметры у них совпадают.
Просмотров: 5795
|
|