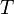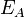Химия - Уравнение Ван-дер-Ваальса - Уравнение состояния
01 марта 2011Оглавление:
1. Уравнение Ван-дер-Ваальса
2. Уравнение состояния
3. Критические параметры
4. Недостатки уравнения Ван-дер-Ваальса
Термическим уравнением состояния называется связь между давлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:
где
- p — давление,
- V — молярный объём,
- T — абсолютная температура,
- R — универсальная газовая постоянная.
Видно, что это уравнение фактически является уравнением состояния идеального газа с двумя поправками. Поправка a учитывает силы притяжения между молекулами, поправка b — силы отталкивания.
Для ν молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
где
- V — объём,
Внутренняя энергия газа Ван-дер-Ваальса
Потенциальная энергия межмолекулярных сил взаимодействия вычисляется как работа, которую совершают эти силы, при разведении молекул на бесконечность:
Внутренняя энергия газа Ван-дер-Ваальса складывается из его кинетической энергии и только что нами посчитанной потенциальной. Так, для одного моль газа:
где 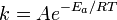 — молярная теплоёмкость при постоянном объёме, которая предполагается не зависящей от температуры.
— молярная теплоёмкость при постоянном объёме, которая предполагается не зависящей от температуры.
Просмотров: 5792
|
|