Химия - Водород - Физические свойства
01 марта 2011Оглавление:
1. Водород
2. История
3. Распространённость
4. Получение
5. Физические свойства
6. Изотопы
7. Свойства изотопов
8. Геохимия водорода
9. Особенности обращения
10. Интересные факты


Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л, температура кипения −252,76 °C, удельная теплота сгорания 120.9×10 Дж/кг, малорастворим в воде — 18,8 мл/л. Водород хорошо растворим во многих металлах, особенно в палладии. С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом. Практически не растворим в серебре.
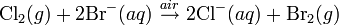
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая и текучая. Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2.
Твердый водород, температура плавления −259,2 °C, плотность 0,0807 г/см³ — снегоподобная масса, кристаллы гексогональной сингонии, пространственная группа P6/mmc, параметры ячейки a=3,75 c=6,12. При высоком давлении водород переходит в металлическое состояние.
Молекулярный водород существует в двух спиновых формах — в виде орто- и параводорода. В молекуле ортоводорода o-H2 ядерные спины направлены одинаково, а у параводорода p-H2 — противоположно друг другу. Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.

Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси. Без катализатора превращение происходит медленно, что даёт возможность изучить свойства отдельных модификаций.
Просмотров: 16137
|
|