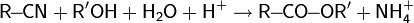Химия - Водородный показатель
28 февраля 2011Оглавление:
1. Водородный показатель
2. Значения pH в растворах различной кислотности
3. Методы определения значения pH
4. Роль pH в химии и биологии
Водородный показатель, pH — мера активности ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный десятичный логарифм активности водородных ионов, выраженной в молях на литр:
История
Это понятие было введено в 1909 году датским химиком Сёренсеном. Показатель называется pH, по первым буквам латинских слов potentia hydrogeni — сила водорода, или pondus hydrogenii — вес водорода. Вообще в химии сочетанием pX принято обозначать величину, равную -lgX, а буква H в данном случае обозначает концентрацию ионов водорода, или, точнее, термодинамическую активность оксоний-ионов.
Уравнения, связывающие pH и pOH
Вывод значения pH
В чистой воде при 22 °C концентрации ионов водорода и гидроксид-ионов одинаковы и составляют 10 моль/л, это напрямую следует из определения ионного произведения воды, которое равно · и составляет 10 моль²/л².
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда > говорят, что раствор является кислым, а при > — щелочным.
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентраций ионов водорода пользуются их десятичным логарифмом, взятым с обратным знаком, который собственно и является водородным показателем — pH.
pOH
Несколько меньшее распространение получила обратная pH величина — показатель основности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH:
как в любом водном растворе при 22 °C = 1,0×10 , очевидно, что при этой температуре:
Просмотров: 8231
|
|