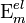Химия - Вязкость - Вязкость газов
28 февраля 2011Оглавление:
1. Вязкость
2. Сила вязкого трения
3. Вязкость газов
4. Вязкость жидкостей
5. Вязкость аморфных материалов
6. Относительная вязкость
В кинетической теории газов коэффициент внутреннего трения вычисляется по формуле
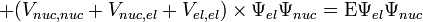 ,
,
где 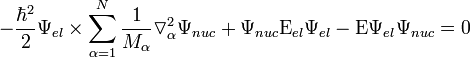 — средняя скорость теплового движения молекул,
— средняя скорость теплового движения молекул, 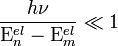 − средняя длина свободного пробега. Из этого выражения в частности следует, что вязкость не очень разреженных газов практически не зависит от давления, поскольку плотность ρ прямо пропорциональна давлению, а
− средняя длина свободного пробега. Из этого выражения в частности следует, что вязкость не очень разреженных газов практически не зависит от давления, поскольку плотность ρ прямо пропорциональна давлению, а 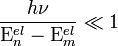 - обратно пропорциональна. Такой же вывод следует и для других кинетических коэффициентов для газов,например, для коэффициента теплопроводности. Однако этот вывод справедлив только до тех пор, пока разрежение газа не становится столь малым, что отношение длины свободного пробега к линейным размерам сосуда не становится по порядку величины равным единице; в частности, это имеет место в сосудах Дьюара.
- обратно пропорциональна. Такой же вывод следует и для других кинетических коэффициентов для газов,например, для коэффициента теплопроводности. Однако этот вывод справедлив только до тех пор, пока разрежение газа не становится столь малым, что отношение длины свободного пробега к линейным размерам сосуда не становится по порядку величины равным единице; в частности, это имеет место в сосудах Дьюара.
С повышением температуры вязкость большинства газов увеличивается, это объясняется увеличением средней скорости молекул газа u, растущей с температурой как 
Влияние температуры на вязкость газов
Формула Сазерленда может быть использована для определения вязкости идеального газа в зависимости от температуры:
где:
- μ = динамическая вязкость в при заданной температуре T,
- μ0 = контрольная вязкость в при некоторой контрольной температуре T0,
- T = заданная температура в Кельвинах,
- T0 = контрольная температура в Кельвинах,
- C = постоянная Сазерленда для того газа, вязкость которого требуется определить.
Эту формулу можно применять для температур в диапазоне 0 < T < 555 K и при давлениях менее 3,45 МПа с ошибкой менее 10%, обусловленной зависимостью вязкости от давления.
Постоянная Сазерленда и контрольные вязкости газов при различных температурах приведены в таблице ниже
| Газ | C | T0 | μ0 |
|---|---|---|---|
| Воздух | 120 | 291.15 | 18.27 |
| Азот | 111 | 300.55 | 17.81 |
| Кислород | 127 | 292.25 | 20.18 |
| Углекислый газ | 240 | 293.15 | 14.8 |
| Угарный газ | 118 | 288.15 | 17.2 |
| Водород | 72 | 293.85 | 8.76 |
| Аммиак | 370 | 293.15 | 9.82 |
| Оксид серы | 416 | 293.65 | 12.54 |
| Гелий | 79.4 | 273 | 19 |
См. также.
Просмотров: 10505
|
|