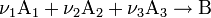Химия - Закон действующих масс
28 февраля 2011Оглавление:
1. Закон действующих масс
2. Закон действующих масс в химической термодинамике
Закон действующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.
Закон действующих масс в химической кинетике
Закон действующих масс в кинетической форме гласит, что скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции. Это положение сформулировано в 1867 году норвежскими учёными К. Гульдбергом и П. Вааге. Для элементарной химической реакции:
закон действующих масс может быть записан в виде кинетического уравнения вида:
где 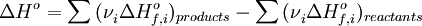 — скорость химической реакции,
— скорость химической реакции, 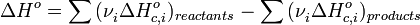 — константа скорости реакции.
— константа скорости реакции.
Для сложных реакций в общем виде это соотношение не выполняется. Тем не менее, многие сложные реакции условно можно рассматривать как ряд последовательных элементарных стадий с неустойчивыми промежуточными продуктами, формально эквивалентный переходу из начального состояния в конечное в «один шаг». Такие реакции называют формально простыми. Для формально простых реакций кинетическое уравнение может быть получено в виде:
. Здесь 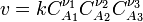 ,
, 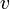 ,
, 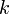 — порядок реакции по веществам
— порядок реакции по веществам 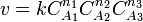 ,
, 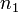 ,
, 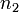 соответственно, а сумма
соответственно, а сумма 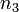 — общий порядок реакции.
— общий порядок реакции. 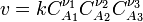 ,
, 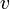 ,
, 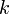 могут быть не равны стехиометрическим коэффициентам и не обязательно целочисленные.
могут быть не равны стехиометрическим коэффициентам и не обязательно целочисленные. 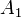 при определённых условиях может быть равно и нулю.
при определённых условиях может быть равно и нулю.
Просмотров: 4987
|
|