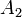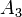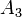Химия - Закон действующих масс - Закон действующих масс в химической термодинамике
28 февраля 2011Оглавление:
1. Закон действующих масс
2. Закон действующих масс в химической термодинамике
В химической термодинамике закон действующих масс связывает между собой равновесные активности исходных веществ и продуктов реакции, согласно соотношению:
где
- ai — активность веществ. Вместо активности могут быть использованы концентрация, парциальные давления, фугитивность;
- νi — стехиометрический коэффициент;
- Ka — константа химического равновесия. Индекс «a» здесь означает использование величины активности в формуле.
На практике в расчётах, не требующих особой точности, значения активности обычно заменяются на соответствующие значения концентраций либо парциальных давлений. Константу равновесия при этом обозначают Kc или Kp соответственно. Впервые закон действующих масс был выведен из кинетических представлений Гульдбергом и Вааге, а термодинамический вывод его дан Вант-Гоффом в 1885 году.
Пример: для стандартной реакции
константа химического равновесия определяется по формуле
Просмотров: 4986
|
|