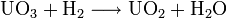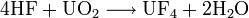Химия - Актиноиды - Соединения
28 февраля 2011Оглавление:
1. Актиноиды
2. Изотопы
3. Распространение в природе
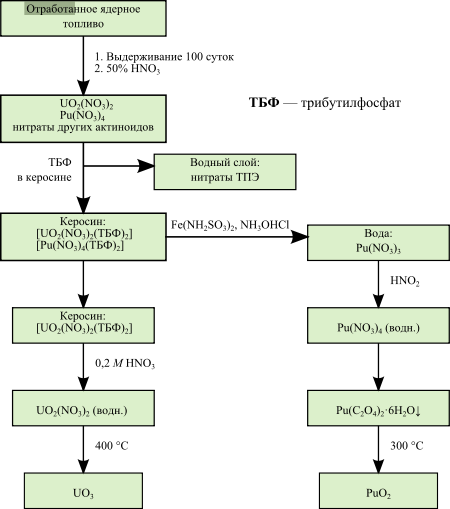
4. Получение
5. Cвойства
6. Соединения
7. Применение
8. Токсичность
9. Галерея изображений
Оксиды и гидроксиды
Для некоторых актиноидов известно несколько оксидов: M2O3, MO2, M2O5 и MO3. Для всех металлов оксиды M2O3, MO2 и M2O5 — основные, а MO3 — амфотерные. Более выражены основные свойства оксидов. Они легко соединяются с водой, образуя основания:
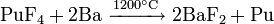 .
.
Данные основания плохо растворяются в воде, а по своей активности близки к гидроксидам редкоземельных металлов. Наиболее сильным из этих оснований является гидроксид актиния. Актиний сравнительно легко взаимодействует с водой, вытесняя водород. Все соединения актиния, кроме его чёрного сульфида, имеют белую окраску.
Оксиды четырёхвалентных актиноидов кристаллизуются в кубическую сингонию, структура кристалла типа флюорита.
| Диоксиды некоторых актинидов | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Название соединения | Диоксид тория | Диоксид протактиния | Диоксид урана | Диоксид нептуния | Диоксид плутония | Диоксид америция | Диоксид кюрия | Диоксид берклия | Диоксид калифорния |
| CAS-номер | 1314-20-1 | 12036-03-2 | 1344-57-6 | 12035-79-9 | 12059-95-9 | 12005-67-3 | 12016-67-0 | 12010-84-3 | 12015-10-0 |
| PubChem | 14808 | 10916 | |||||||
| Химическая формула | ThO2 | PaO2 | UO2 | NpO2 | PuO2 | AmO2 | CmO2 | BkO2 | CfO2 |
| Молярная масса | 264,04 г·моль | 263,035 г·моль | 270,03 г·моль | 269,047 г·моль | 276,063 г·моль | 275,06 г·моль | 270–284 г·моль | 279,069 г·моль | 283,078 г·моль |
| Температура плавления | 3390 °C | 2878 °C | 2600 °C | 2400 °C | 2050 °C | ||||
| Температура кипения | 4400 °C | 2800 °C | |||||||
| Структура |  An: __ / O: __ |
||||||||
| Пространственная группа |  |
||||||||
| Координационное число | An, O | ||||||||
- An — актиноид

Торий, соединяясь с кислородом, образует лишь диоксид. Его можно получить при сжигании металлического тория в кислороде при температуре в 1000 °C, или нагреванием некоторых его солей:
Диоксид тория является тугоплавким веществом, очень стоек к нагреванию. Из-за этого свойства диоксид тория иногда используют в производстве огнеупорных материалов. Добавление 0,8—1 % ThO2 к чистому вольфраму стабилизирует его структуру; поэтому волоски электроламп имеют лучшую устойчивость при вибрациях.
Диоксид тория — основный оксид, но непосредственно при реакции металла с водой он не получится. Чтобы растворить ThO2 в кислотах его сначала нагревают до температуры 500—600 °C. Более сильное нагревание способствует получению очень стойкой к кислотам и другим реагентам структуры ThO2. Небольшая добавка фторид-ионов катализирует растворение торий и его диоксида в кислотах.

У протактиния получено два оксида: PaO2 и Pa2O5. Первый из них изоморфен с ThO2. Легче получить Pa2O5. Оба оксида протактиния основные. Для пятивалентного протактиния можно получить Pa5 — слабое плохо растворимое основание.
При разложении некоторых солей урана можно получить оранжевый или жёлтый UO3. Данный оксид является амфотерным; он непосредственно получается при взаимодействии с водой и создает несколько гидроксидов, из которых наиболее стабильным является UO22.
При реакции оксида урана с водородом получается диоксид урана, который схож по своим свойствам с ThO2. Этот оксид также является основным. Ему соответствует тетрагидроксид урана4).
Плутоний, нептуний и америций образуют оксиды двух типов: M2O3 и MO2, которые обладают основными свойствами. У кюрия получены белый Cm2O3 и чёрный CmO2, у калифорния — Cf2O3. Оксиды остальных актиноидов плохо изучены. Триоксид нептуния является менее стойким, чем оксид урана, поэтому он не получен в чистом виде. В то же время, хорошо изучены оксиды плутония и нептуния с химической формулой MO2 и M2O3.
Оксиды новых элементов часто исследуются первыми, что связано с их большим значением, лёгкостью получения и с тем фактом, что оксиды обычно служат в качестве промежуточных соединений при получении других веществ.
| Оксиды актиноидов | |||||||
|---|---|---|---|---|---|---|---|
| Соединение | Цвет | Сингония и структурный тип | Параметры ячейки, Å | Плотность, г/см³ | Область существования, °C | ||
| a | b | c | |||||
| Ac2O3 | Белый | Гексагональная, La2O3 | 4,07 | — | 6,29 | 9,19 | — |
| PaO2 | — | Кубическая, CaF2 | 5,505 | — | — | — | — |
| Pa2O5 | Белый | Кубическая, CaF2 Квадратичная Тетрагональная Гексагональная Ромбоэдрическая Орторомбическая |
5,446 10,891 5,429 3,817 5,425 6,92 |
— — — — — 4,02 |
— 10,992 5,503 13,22 — 4,18 |
— | 700 700—1100 1000 1000—1200 1240—1400 — |
| ThO2 | Бесцветный | Кубическая | 5,59 | — | — | 9,87 | — |
| UO2 | Чёрно-коричневый | Кубическая | 5,47 | — | — | 10,9 | — |
| NpO2 | Зеленовато-коричневый | Кубическая, CaF2 | 5,424 | — | — | 11,1 | — |
| PuO | Чёрный | Кубическая, NaCl | 4,96 | — | — | 13,9 | — |
| PuO2 | Оливково-зелёный | Кубическая | 5,39 | — | — | 11,44 | — |
| Am2O3 | Красновато-коричневый Рыжевато-коричневый |
Кубическая, Mn2O3 Гексагональная, La2O3 |
11,03 3,817 |
— | — 5,971 |
10,57 11,7 |
— |
| AmO2 | Чёрный | Кубическая, CaF2 | 5,376 | — | — | — | — |
| Cm2O3 | Белый — — |
Кубическая, Mn2O2 Гексагональная, LaCl3 Моноклинная, Sm2O3 |
11,01 3,80 14,28 |
— — 3,65 |
— 6 8,9 |
11,7 | — |
| CmO2 | Чёрный | Кубическая, CaF2 | 5,37 | — | — | — | — |
| Bk2O3 | Светло-коричневый | Кубическая, Mn2O3 | 10,886 | — | — | — | — |
| BkO2 | Рыжевато-коричневый | Кубическая, CaF2 | 5,33 | — | — | — | — |
| Cf2O3 | Бесцветный Желтоватый — |
Кубическая, Mn2O3 Моноклинная, Sm2O3 Гексагональная, La2O3 |
10,79 14,12 3,72 |
— 3,59 — |
— 8,80 5,96 |
— | — |
| CfO2 | Чёрный | Кубическая | 5,31 | — | — | — | — |
| Es2O3 | — | Кубическая, Mn2O3 Моноклинная Гексагональная, La2O3 |
10,07 1,41 3,7 |
— 3,59 — |
— 8,80 6 |
— | — |
Соли кислот
Металлы-актиноиды хорошо соединяются с галогенами, создавая соли MHa3 и MHa4, так был получен хлорид калифорния. В 1962 году было синтезировано первое соединение берклия — BkCl3 в количестве 0,000003 мг.

Подобно галогенам редкоземельных элементов хлориды, бромиды и иодиды актиноидов растворяются в воде, а фториды — нерастворимы. У урана сравнительно легко получить бесцветный гексафторид, который способен возгоняться при температуре в 56,5 °C. Из-за легкости UF6 его применяют при разделении изотопов урана диффузным методом.
Гексафториды актиноидов по свойствам приближаются к ангидридам. В воде они гидролизуются, образуя MO2F2. Также были синтезированы пентахлорид и чёрный гексахлорид урана, но они оба являются нестабильными .
При воздействии кислот на актиний, торий, протактиний, уран, нептуний и пр. получаются соли. В случае, если на них действовать кислотами-неокислителями, как правило, можно получить соли низкой валентности металлов:
Однако в ходе данных реакций восстанавливающий водород может реагировать с самим металлом, образуя соответствующий гидрид металла. С кислотами и водой уран реагирует значительно легче, чем торий.
Хлориды трёхвалентных актиноидов кристаллизуются в гексагональную сингонию.
| Трихлориды некоторых актиноидов | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Название соединения | Хлорид актиния | Хлорид урана | Хлорид нептуния | Хлорид нептуния | Хлорид америция | Хлорид кюрия | Хлорид берклия | Хлорид калифорния | |
| CAS-номер | 22986-54-5 | 10025-93-1 | 20737-06-8 | 13569-62-5 | 13464-46-5 | 13537-20-7 | 13536-46-4 | 13536-90-8 | |
| PubChem | 167444 | ||||||||
| Химическая формула | AcCl3 | UCl3 | NpCl3 | PuCl3 | AmCl3 | CmCl3 | BkCl3 | CfCl3 | |
| Молярная масса | 333,386 г·моль | 344,387 г·моль | 343,406 г·моль | 350,32 г·моль | 349,42 г·моль | 344–358 г·моль | 353,428 г·моль | 357,438 г·моль | |
| Температура плавления | 837 °C | 800 °C | 767 °C | 715 °C | 695 °C | 603 °C | 545 °C | ||
| Температура кипения | 1657 °C | 1767 °C | 850 °C | ||||||
| Структура | 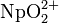 An: __ / Cl: __ |
||||||||
| Пространственная группа | 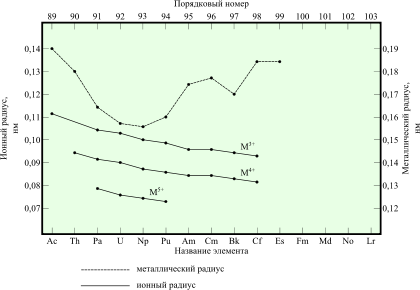 |
||||||||
| Координационное число | An*, Cl | ||||||||
| Постоянная решётки | a = 762 пм c = 455 пм |
a = 745,2 пм c = 432,8 пм |
a = 739,4 пм c = 424,3 пм |
a = 738,2 пм c = 421,4 пм |
a = 726 пм c = 414 пм |
a = 738,2 пм c = 412,7 пм |
a = 738 пм c = 409 пм |
||
- *An — актиноид
| Фториды актиноидов | ||||||
|---|---|---|---|---|---|---|
| Соединение | Цвет | Сингония, структурный тип | Параметры ячейки, Å | Плотность, г/см³ | ||
| a | b | c | ||||
| AcF3 | Белый | Гексагональная, LaF3 | 4,27 | — | 7,53 | 7,88 |
| PaF4 | Тёмно-коричневый | Моноклинная | 12,7 | 10,7 | 8,42 | — |
| PaF5 | Чёрный | Тетрагональная, β-UF5 | 11,53 | — | 5,19 | — |
| ThF4 | Бесцветный | Моноклинная | 13 | 10,99 | 8,58 | 5,71 |
| UF3 | Красновато-фиолетовый | Гексагональная | 7,18 | — | 7,34 | 8,54 |
| UF4 | Зелёный | Моноклинная | 11,27 | 10,75 | 8,40 | 6,72 |
| α-UF5 | Голубоватый | Тетрагональная | 6,52 | — | 4,47 | 5,81 |
| β-UF5 | Голубоватый | Тетрагональная | 11,47 | — | 5,20 | 6,45 |
| UF6 | Желтоватый | Орторомбическая | 9,92 | 8,95 | 5,19 | 5,06 |
| NpF3 | Чёрный или пурпурный | Гексагональная | 7,129 | — | 7,288 | 9,12 |
| NpF4 | Светло-зелёный | Моноклинная | 12,67 | 10,62 | 8,41 | 6,8 |
| NpF6 | Оранжевый | Орторомбическая | 9,91 | 8,97 | 5,21 | 5 |
| PuF3 | Фиолетово-синий | Тригональная | 7,09 | — | 7,25 | 9,32 |
| PuF4 | Бледно-коричневый | Моноклинная | 12,59 | 10,57 | 8,28 | 6,96 |
| PuF6 | Красновато-коричневый | Орторомбическая | 9,95 | 9,02 | 3,26 | 4,86 |
| AmF3 | Розовый или светло-бежевый | Гексагональная, LaF3 | 7,04 | — | 7,255 | 9,53 |
| AmF4 | Оранжево-красный | Моноклинная | 12,53 | 10,51 | 8,20 | — |
| CmF3 | От шоколадно-коричневого до блестящего белого | Гексагональная | 4,041 | — | 7,179 | 9,7 |
| CmF4 | Жёлтый | Моноклинная, UF4 | 12,51 | 10,51 | 8,20 | — |
| BkF3 | Жёлто-зелёный | Тригональная, LaF3 Орторомбическая, YF3 |
6,97 6,7 |
— 7,09 |
7,14 4,41 |
10,15 9,7 |
| BkF4 | — | Моноклинная, UF4 | 12,47 | 10,58 | 8,17 | — |
| CfF3 | — — |
Тригональная, LaF3 Орторомбическая, YF3 |
6,94 6,65 |
— 7,04 |
7,10 4,39 |
— |
| CfF4 | — — |
Моноклинная, UF4 Моноклинная, UF4 |
1,242 1,233 |
1,047 1,040 |
8,126 8,113 |
— |
Соли актиноидов легко получаются при растворении соответствующих гидроксидов в кислотах. В свою очередь, нитраты, хлориды, перхлораты и сульфаты актиноидов могут растворяться в воде. Из водных растворов эти соли кристаллизуются, образуя гидраты, например:
- Th4·6H2O,
- Th2·9H2O,
- Pu23·7H2O.
Ещё одним свойством этих соединений является способность солей актиноидов высшей валентности к легкому гидролизу. Так, бесцветные средние сульфат, хлорид, перхлорат, нитрат тория в растворе быстро переходят в основные соли с химическими формулами Th2SO4, Th3NO3.

Своей растворимостью соли трехвалентных и четырёхвалентных актиноидов подобны солям лантаноидов. Как и для лантана и его аналогов, плохо растворяются в воде фосфаты, фториды, оксалаты, иодаты, карбонаты актиноидов. В этом случае почти все плохорастворимые соли осаждаются в растворе в виде кристаллогидратов, например, ThF4·3H2O, Th2·3H2O.
Актиноиды со степенью окисления +6, кроме катионных комплексов типа  , создают анионы, и некоторые более сложные соединения. Например, у урана, нептуния и плутония известны соли типа уранатов и дитиуранатов2U2O7).
, создают анионы, и некоторые более сложные соединения. Например, у урана, нептуния и плутония известны соли типа уранатов и дитиуранатов2U2O7).
По сравнению с лантаноидами, актиноиды лучше создают координационные соединения. Способность к образованию комплексных соединений у актиноидов увеличивается с увеличением валентности металла. Трёхвалентные актиноиды не образуют фторидных координационных соединений, в то время как четырёхвалентный торий образует соли типа K2ThF6, KThF5 и даже K5ThF9. Для данного металла легко можно получить соответствующие сульфаты, например Na2SO4·Th2·5H2O, нитраты, тиоцианаты. Соли с общей формулой M2Th6·nH2O имеют координационную природу, в них у тория координационное число равно 12. Ещё легче комплексные соли создают пятивалентные и шестивалентные актиноиды. Достаточно стойкие комплексы образуют торий и уран с роданид-ионами. Эти комплексы имеют повышенную стойкость в неводных растворителях.
Также стоит отметить, что наиболее устойчивые координационные соединения актиноидов — четырёхвалентные торий и уран — получаются при реакции с дикетонами, например с ацетилацетоном.
Просмотров: 20625
|
|