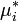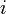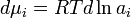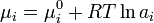Химия - Активность (химия) - Выбор стандартного состояния
06 мая 2011Оглавление:
1. Активность (химия)
2. Выбор стандартного состояния
3. Методы определения активности
При использовании активности и коэффициента активности важную роль играет выбор стандартного состояния компонента, то есть состояния, в котором 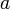
Для растворов взаимно неограниченно растворимых жидкостей в качестве стандартного может быть выбрано состояние чистого компонента:
- при
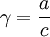
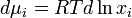 и
и 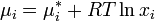
Иногда такой выбор называют симметричной системой стандартного состояния.
В случае, если рассматривается раствор газа и или твердого вещества в жидкости, мольную долю растворенного вещества нельзя изменять до единицы. Тогда для растворителя — жидкости — стандартное состояние может быть выбрано так же, как показано выше, а для растворенного вещества за стандартное состояние принимают гипотетический раствор с концентрацией, равной единице, но сохраняющий свойства предельно разбавленного раствора. Иначе говоря, это такое состояние, для которого давление пара численно равно константе Генри:
Таким образом, для растворителя и растворенного вещества здесь принимаются разные стандартные состояния — это несимметричная система стандартных состояний.
В системах с ограниченной растворимостью за стандартное может быть принято состояние компонента в насыщенном растворе:
В засимости от исследуемой системы, в качестве стандартного может быть выбрано и другое состояние, например, для серы при исследовании богатых сульфидных расплавов — состояние серы в стехиометрическом сульфиде. При рассмотрении результатов эксперимента, использовании справочных данных и т. п. следует обязательно указывать, какое именно состояние компонента принято за стандартное.
Просмотров: 6963
|
|