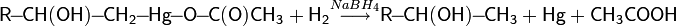Химия - Алкены - Химические свойства
28 февраля 2011Оглавление:
1. Алкены
2. Электронное строение двойной связи
3. История открытия
4. Нахождение в природе и физиологическая роль алкенов
5. Физические свойства
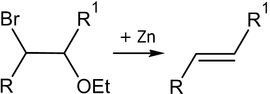
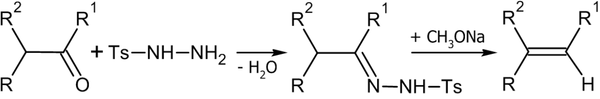
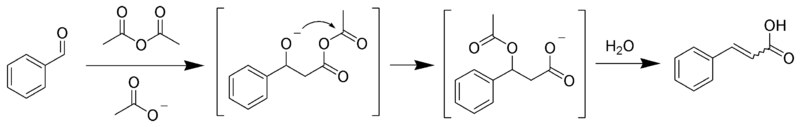
6. Методы получения алкенов
7. Химические свойства
8. Идентификация алкенов
9. Применение алкенов
Алкены химически активны. Их химические свойства во многом определяются наличием двойной связи. Для алкенов наиболее характерны реакции электрофильного присоединения и реакции радикального присоединения. Реакции нуклеофильного присоединения обычно требуют наличие сильного нуклеофила и для алкенов не типичны.
Особенностью алкенов являются также реакции циклоприсоединения и метатезиса.
Алкены легко вступают в реакции окисления, гидрируются сильными восстановителями или водородом под действием катализаторов до алканов, а также способны к аллильному радикальному замещению.
Реакции электрофильного присоединения
В данных реакциях атакующей частицей является электрофил.
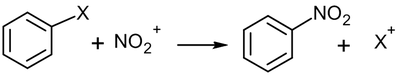
Галогенирование
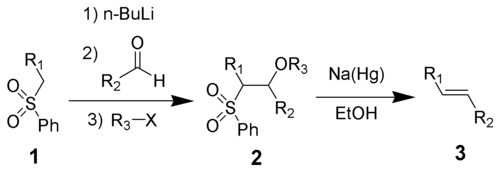
Галогенирование алкенов, проходящее в отсутствии инициаторов радикальных реакций — типичная реакция электрофильного присоединения. Она проводится в среде неполярных инертных растворителей:
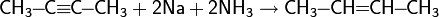
Реакция галогенирования стереоспецифична —- присоединение происходит с противоположных сторон относительно плоскости молекулы алкена
Механизм реакций подобного типа в общем виде:
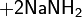
Гидрогалогенирование
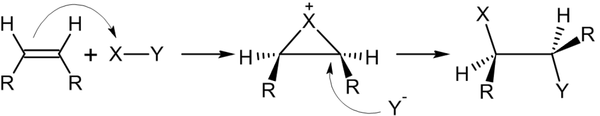
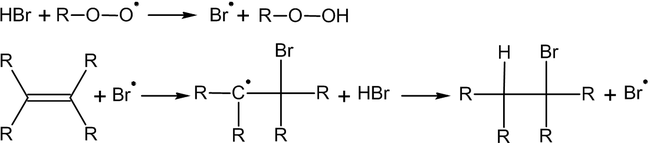
Электрофильное присоединение галогенводородов к алкенам происходит по правилу Марковникова:
Однако в присутствии перекисей присоединение происходит против этого правила:
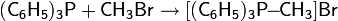
Это объясняется тем, что реакция в данном случае будет протекать по радикальному механизму:
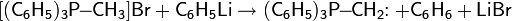
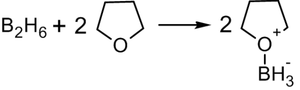
Гидроборирование
Присоединение гидридов бора к алкенам и последующее их расщепление в щелочной среде, открытое Г. Брауном в 1958 году, является столь важной реакцией, что за ее обнаружение и изучение в 1979 году ученый был удостоен Нобелевской премии по химии.
Присоединение происходит многоступенчато с образованием промежуточного циклического активированного комплекса, причем присоединение бора происходит против правила Марковникова — к наиболее гидрогенизированному атому углерода:
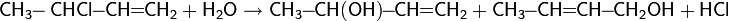
В синтезе используется, обычно, не собственно диборан, а его донорно-акцептоный комплекс с простым эфиром:
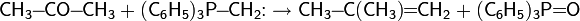
Алкилбораны легко расщепляются. Так под действием пероксида водорода в щелочной среде образуются спирты:
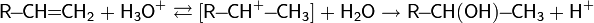
Реакция гидроборирования является реакцией син-присоединения — ее результатом становятся цис-аддукты.
Гидратация
Реакция присоединения воды к алкенам протекает в присутствии серной кислоты:
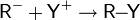
Реакция протекает по правилу Марковникова.
Алкилирование
Присоединение алканов к алкенам в присутствии кислотного катализатора при низких температурах приводит к образованию углеводорода с большей молекулярной массой и часто используется в промышленности:
Данная реакция также может протекать по свободнорадикальному механизму в отсутствие катализатора при высокой температуре и давлении.
Прочие реакции электрофильного присоединения
Для алкенов также характерны следующие реакции электрофильного присоединения:
- Присоединение спирта с образованием простого эфира:
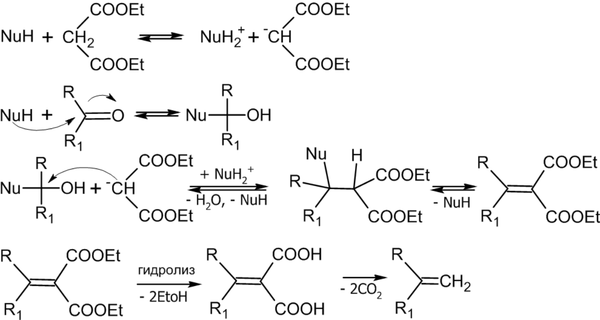
- Получение спиртов по реакции оксимеркурирования-демеркурирования:
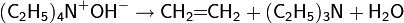
- Присоединение хлорноватистой кислоты с образованием хлоргидринов:
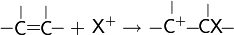
- Присоединение хлорангидридов с дальнейшим получением ненасыщенных кетонов:
Реакции радикального присоединения
В условиях, способствующих гомолитическому разрыву связи, присоединение к алкенам происходит по радикальному механизму.
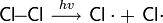
и т. п.
Механизм реакции:
Реакции присоединения карбенов
Карбены CR2: — высокореакционные короткоживущие частицы, которые способны легко присоединяться к двойной связи алкенов. В результате реакции присоединения карбена образуются производные циклопропана:
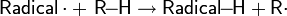
Карбены в более характерном для них синглетном состоянии, вступая в реакцию, дают стереоспецифичные продукты син-присоединения.
Помимо собственно карбена, в подобные реакции могут вступать и его производные:
 и пр.
и пр.
Часто реакции присоединения карбенов происходят без прямых доказательств их свободного присутствия, то есть происходит перенос карбена. Для этого случая, а также если генерация свободного карбена ставится под сомнение, пользуются термином карбеноид.
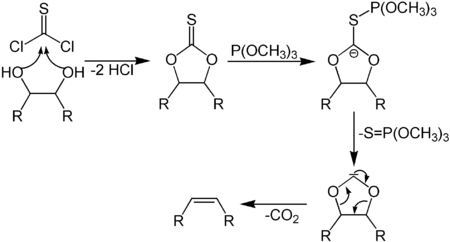
В лабораторной практике часто пользуются реакцией Симмонса-Смита:
Подробнее о методах получения карбенов см. статью Карбены.
Гидрирование

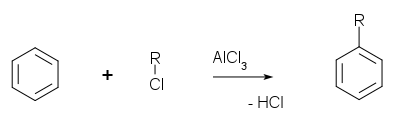
Гидрирование алкенов непосредственно водородом происходит только в присутствии катализатора. Гетерогенными катализаторами гидрирования служат платина, палладий, никель .
Гидрирование можно проводить и в жидкой фазе с гомогенными катализаторами3P)3RhCl).
В качестве реагентов гидрирования могут выступать диимид, диборан и др.
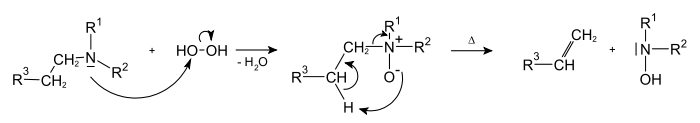
Реакции радикального замещения
При высоких температурах реакции радикального присоединения, носящие обратимый характер, подавляются. В этом случае становится возможным провести замещение атома водорода, находящегося в аллильном положении при сохранении двойной связи:
Реакция носит радикальный характер и протекает аналогично хлорированию алканов.
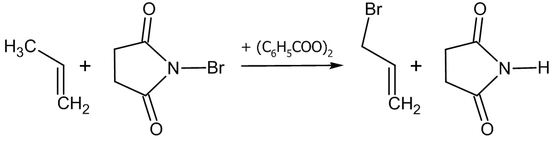
Аллильное бромирование обычно проводят N-бромсукцинимидом в присутствии перекиси бензоила в среде тетрахлорметана или в бинарной смеси диметилсульфоксида и воды:
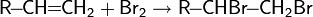
Окисление
Окисление алкенов может происходить в зависимости от условий и видов окислительных реагентов как с разрывом двойной связи, так и с сохранением углеродного скелета.
Окисление неорганическими окислителями
- В мягких условиях возможно окисление посредством присоединения по двойной связи двух гидроксильных групп:
На первом этапе происходит присоединение оксида осмия к алкену, затем под действием воосстановителя образовавшийся комплекс переходит к диолу.
Аналогично реакция идет в нейтральной или слабощелочной среде под действием KMnO4:
- При действии на алкены сильных окислителей при нагревании происходит разрыв двойной связи:
- Некоторые окислители, например нитрат таллия, окисляют алкены с перегруппировкой по следующей схеме:
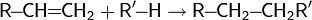
Окисление в присутствии солей палладия
В присутствии солей палладия этилен окисляется до ацетальдегида:
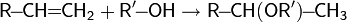
Реакция идет в кислой среде и является промышленным способом получения ацетальдегида.
Аналогично образуется ацетон из пропена.
Эпоксидирование
При действии на алкены пероксикарбоновых кислот образуются эпоксиды:
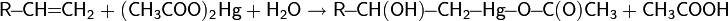
Реакция эпоксидирования используется для промышленного получения этиленоксида. Окислителем выступает кислород воздуха; процесс идет на серебряном катализаторе при 200—250 °C под давлением.
Озонолиз
Озонолиз алкенов обычно проводят при низких температурах в инертном растворителе. Непосредственные продукты озонолиза не выделяют, а подвергают дальнейшему гидролизу, окислению или восстановлению.
- Озонолиз в мягких условиях: алкен окисляется до альдегидов, кетонов или смеси альдегида и кетона.
На первой стадии происходит присоединение озона с образованием озонида. Далее под действием восстановителя озонид разлагается:
Если взять более сильный восстановитель, скажем — алюмогидрид лития, продуктом реакции будут спирты.
- Озонолиз в жёстких условиях — алкен окисляется до кислоты:
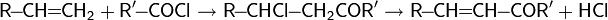
В данном случае разложение озонида происходит под действием окислителей.
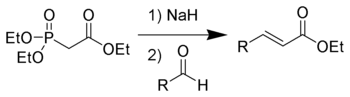
Реакция карбонилирования
Алкены в присутствии катализатора, высокой температуры и давления присоединяют CO и H2 с образованием альдегидов:
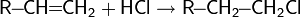
Аналогично протекает реакция CO и H2O с образованием карбоновых кислот :
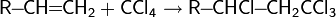
Если вместо воды использовать спирт, конечным продуктом реакции будет сложный эфир :
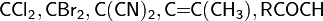
Реакции полимеризации
Полимеризация алкенов может протекать как по свободнорадикальному, так и катионно-анионному механизму.
По первому методу получают полиэтилен высокого давления:
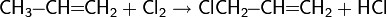
Катализатором реакции выступают пероксиды.
Второй метод предполагает использование в качестве катализаторов кислот, металлорганических соединений. Преимуществом метода является возможность получения стереоселективных полимеров.
Метатезис алкенов
Впервые данный тип реакций был обнаружен в середине прошлого века при изучении полимеризации этилена, а в затем был использован в 1966 году для промышленного синтеза бутена-2.
В 1967 году Н. Кальдерон, Х. Ю Чен и К. В. Скотт описали метатезис алкенов в условиях катализа хлоридом вольфрама:
Реакция оказалась настолько важной в области практической препаративной химии, что исследовательская группа Роберта Груббса, разработавшая новый класс катализаторов метатезиса олефинов, получила в 2005 году Нобелевскую премию в области химии. Справедливости ради, стоит отметить, что эту премию также получили француз Ив Шовен в 1971 году, предложивший карбеновую теорию механизма реакции метатезиса, и американец Ричард Шрок, создавший в 1990 году первый металлорганический катализатор метатезиса алкенов.
В 2008 году польские химики продемонстрировали реакцию метатезиса в водном растворе с использованием коммерчески доступного рутениевого катализатора.
Технологические аспекты метатезиса алкенов рассмотрены в статье: Метатезис олефинов: современный путь к полипропилену
Просмотров: 43061
|
|