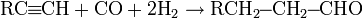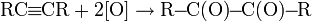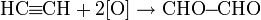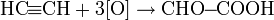Химия - Алкины - Химические свойства
28 февраля 2011Оглавление:
1. Алкины
2. Номенклатура алкинов
3. Физические свойства
4. Нахождение в природе и физиологическая роль алкинов
5. Химические свойства
6. Идентификация алкинов
Кислотные свойства алкинов и реакции нуклеофильного замещения
Образование алкинидов
Алкины с концевой тройной связью являются С-H кислотами которые с очень сильными основаниями могут образовывать соли — алкиниды:
Реакция алкинов с аммиакатами серебра или одновалентной меди является качественной на наличие тройной связи:
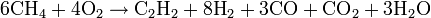
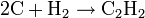
Пропинид серебра представляет собой осадок белого цвета, пропинид меди - осадок жёлтого цвета, наконец, диацетиленид меди - осадок красного цвета.
Алкинид серебра легко растворяется при добавлении цианида натрия с выделением соответствующего алкина:
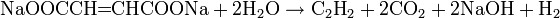
Смотри также статью: Ацетилениды.
Реакции нуклеофильного замещения алкинидов
Алкиниды являются сильными нуклеофилами и легко вступают в реакции нуклеофильного замещения:
Это, в частности, широко используется для синтеза гомологов ацетилена:
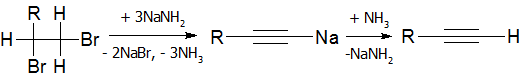
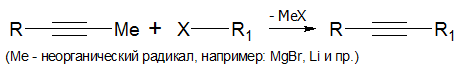
В препаративном синтезе часто используют комплекс ацетиленида лития с этилендиамином как удобный источник ацетиленид-аниона.
Следует отметить, что в случае реакции с вторичными или третичными галогеналканами реакция во многом идет по альтернативному пути:
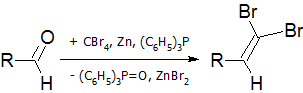
Прочие реакции нуклеофильного замещения
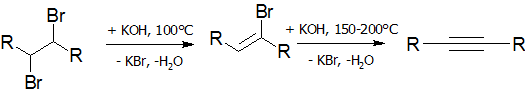
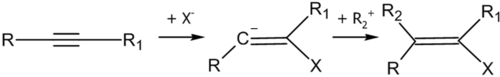
Получение алкингалогенидов
Действием галогена на монозамещенные ацетилены в щелочной среде можно получить галогеналкины:
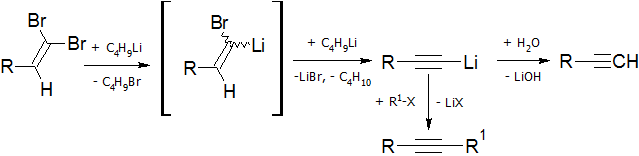
Хлорированием ацетилена хлоридом меди в водных растворах CuCl можно получить дихлорацетилен:
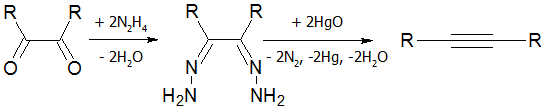
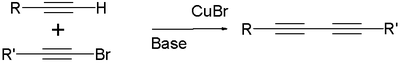
Ацетиленовая конденсация
Ацетиленовая конденсация или иначе реакция Ходкевича-Кадио, заключается во взаимодействии ацетиленовых углеводородов с бром- или йодалкинами с образованием диацетиленов:
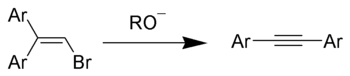
Аналогично протекает и реакция Куртца:
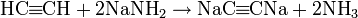
Получение ацетиленаминов
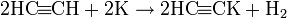
Реакция идет в присутствии солей меди.
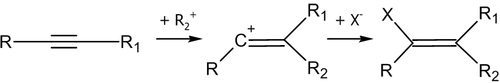
Реакции электрофильного присоединения
Электрофильное присоединение к алкинам инициируется под воздействием положительно заряженной частицы — электрофила. В общем случае, катализатором таких реакций являются кислоты.
Общая схема первой стадии реакции электрофильного присоединения:
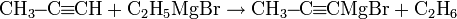
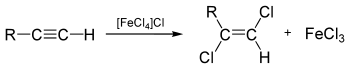
Реакции галогенирования
Алкины способны присоединять одну или две молекулы галогена с образованием соответствующих галогенпроизводных:
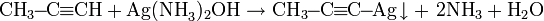
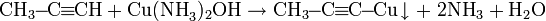
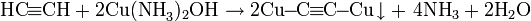
Галогенирование алкинов идет как транс-присоединение и протекает по аналогии с галогенированием алкенов.
Вместе с тем, присоединение по тройной связи идет труднее, чем по двойной, в связи с чем при наличии в соединении как двойной, так и тройной связи, возможно провести избирательное присоединение:
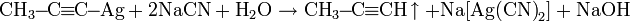
Смотри также статью: Алкены, подраздел «Галогенирование».
Реакции гидрогалогенирования
Присоединение хлороводорода и бромоводорода к алкинам происходит по аналогии с алкенами. Реакция идет в две стадии: сперва образуется галогеналкен, который далее переходит в дигалогеналкан:
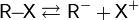
Обе стадии реакции идут по правилу Марковникова. Как видно из схемы, в результате реакции присоединения образуются транс- изомеры.
Смотри также статью: Алкены, подраздел «Гидрогалогенирование».
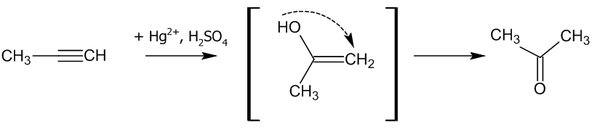
Гидратация
В присутствии солей ртути алкины присоединяют воду с образованием ацетальдегида или кетона. Эта реакция известна как реакция Кучерова.
Считается, что процесс гидратации идет через стадию образования енола:
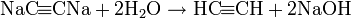
Реакции карбонилирования
Реакция карбонилирования были открыты в лаборатории Реппе в 1939 году.
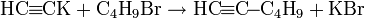
где Х: ОН, OR, OCOR, NH2 и пр.
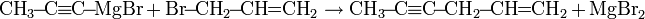
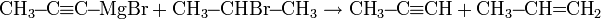
Катализатором реакции являются карбонилы никеля или палладия.
Отдельно стоит упомянуть реакцию оксилительного карбохлорирования:
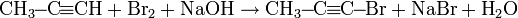
Прочие реакции электрофильного присоединения
- Присоединение карбоновых кислот с образованием диэфиров:
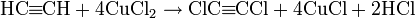
Уксусная кислота в реакции с ацетиленом образует винилацетат:
Ацетиленовые углеводороды присоединяют CO2 и вторичные амины с образованием амидов:
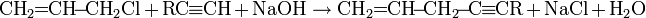
- Реакция с ацетилена с цианистым водородом в присутствии солей одновалентной меди с получением акрилонитрила:
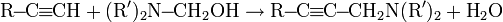
- Ацетилен способен в присутствии катализаторов присоединять углеводороды с образованием новых С-С связей:
или
Реакции нуклеофильного присоединения
Нуклеофильное присоединение к алкинам инициируется под воздействием отрицательно заряженной частицы — нуклеофила. В общем случае, катализатором таких реакций являются основания. Общая схема первой стадии реакции нуклеофильного присоединения:
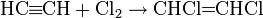
Типовые реакции нуклеофильного присоединения
- Характерным примером реакции нуклеофильного присоединения является Реакция Фаворского — присоединение спиртов в присутствии щелочей с образованием алкенильных эфиров:
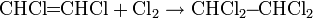
- Первичные амины под действием оснований присоединяются к алкинам с образованием иминов:
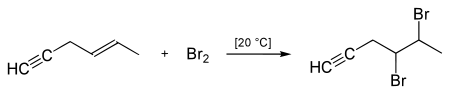
По аналогии ацетилен реагирует с аммиаком, образуя этилиденимин:
При высокой температуре в присутствии катализатора имин дегидрируется и превращается в ацетонитрил:
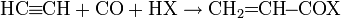
- В среде очень сильных оснований ацетилен реагирует с сероводородом, образуя дивинилсульфид:
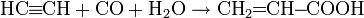
Реакции радикального присоединения
В присутствии перекисей или других условиях, способствующих образованию свободных радикалов, присоединение к алкинам идет по радикальному механизму — против правила Марковникова:
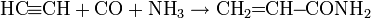
По свободнорадикальному механизму* может протекать реакция алкинов с тиолами:
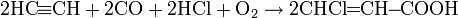
* — В присутствии оснований реакция идет по нуклеофильному механизму.
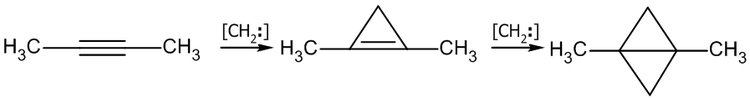
Аналогично происходит присоединение карбенов:
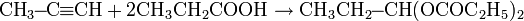
Смотри также статью: Алкены, подраздел «Реакции радикального присоединения».
Реакции этинилирования
Реакциями этинилирования называют реакции увеличения углеродного скелета алкинов с сохранением тройной связи. Они могут протекать как по электрофильному, так и нуклеофильному механизму в зависимости от среды и условий реакции, характера субстрата, а также типа используемого катализатора.
Получение ацетиленовых спиртов
В присутствии сильных оснований алкины с концевой тройной связью способны присоединять карбонильные соединения с образованием спиртов:
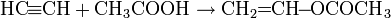
Важнейшей реакцией из этой группы является присоединения формальдегида к ацетилену с образованием пропаргилового спирта и далее бутин-2-диола-1,4:
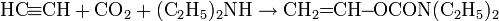
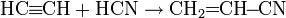
* Бутин-2-диол-1,4 является важным промежуточным полупродуктом для получения бутиленгликоля, γ-Бутиролактона, изопрена и тетрагидрофурана.
Эту реакцию разработал в 1925 году Реппе. Она протекает при высоком давлении в присутствии ацетиленида меди.
Смотри также статью: Именные реакции в органической химии, подраздел «Реакция Фаворского-Реппе».
Получение ацетиленовых эфиров и кислот
Ацетиленовые кислоты или их эфиры можно получить по реакции Цужи:
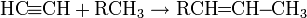
Катализаторы: PdCl2, CuCl.
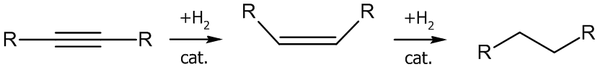
Реакции гидрирования
Гетерогенное гидрирование
Гидрирование алкинов водородом на гетерогенных катализаторах, как правило, приводит к образованию цис-присоединения. Катализаторами гидрирования служат Ni, Pd, Pt, а также оксиды или комплексы Ir, Rh, Ro и некоторых других металлов.
На первой стадии образуется алкен, который практически сразу же гидрируется до алкана:
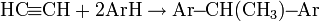
Для остановки реакции на стадии получения алкена используют катализаторы Линдлара или борид никеля.
При гидрировании ацетилена на никель-кобальтовом катализаторе можно получить изобутилен:
Гомогенное гидрирование
Гомогенное гидрирование проводят в амидом натрия в жидком аммиаке или алюмогидридом лития в тетрагидрофуране. В ходе реакции образуются транс-алкены.
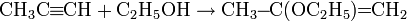
Гидроборирование
Алкины легко присоединяют диборан против правила Марковникова, образуя цис-алкенилбораны:
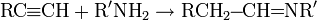
Реакция интересна тем, что далее алкенилбораны легко перевести в соответствующие цис-алкены простым действием уксусной кислоты:
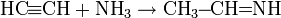
или окислить H2O2 до альдегида или кетона:
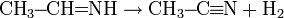
Восстановительное карбоксилирование
По аналогии с реакциями алкенов, алкины вступают в реакцию восстановительного карбоксилирования. В зависимости от условий реакции и типов катализаторов, конечными продуктами могут стать спирты, альдегиды или алканы:
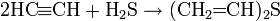
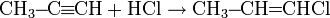
Смотри также статью: Алкены, подраздел «Реакции карбонилирования».
Реакции окисления
Реакции окислительного присоединения
Алкины окисляются более трудно чем алкены, однако при контролируемом окислении можно сохранить C-C связь и получить в качестве продуктов реакции карбонильные соединения:
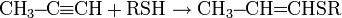
В качестве окислителя может выступать озон, KMnO4 в слабощелочной или нейтральной среде и некоторые другие вещества.
Ацетилен, в зависимости от окислителя может давать три продукта:
 — окисление разбавленной HNO3 в присутствии PdCl2 и NaNO2.
— окисление разбавленной HNO3 в присутствии PdCl2 и NaNO2.
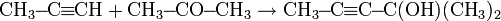 — окисление KClO3 в субстрате вода+диэтиловый эфир.
— окисление KClO3 в субстрате вода+диэтиловый эфир.
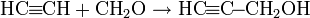 — окисление KMnO4 в кислой среде или HNO3 в присутствии PdCl2.
— окисление KMnO4 в кислой среде или HNO3 в присутствии PdCl2.
Отдельный тип реакций — реакции оксилительного карбоксилирования.
В растворах комплексов палладия образуются эфиры малеиновой кислоты:
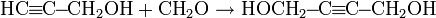
Реакции окислительного расщепления
При действии сильных окислителей в жестких условиях алкины окисляются с разрывом тройной связи. В ходе реакции образуются карбоновые кислоты и CO2:
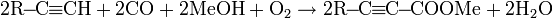
Реакции оксилительного сочетания
В присутствии солей одновалентной меди в спиртовом растворе аммиака алкины окисляются кислородом воздуха до диацетиленов:
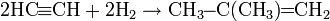
Реакция для ацетилена может идти c образованием полиинов:
Эта реакция легла в основу синтеза карбина.
Реакции изомеризации
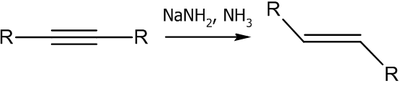
В 1887 году А.Е Фаворским была открыта изомеризация алкинов под действием сильных оснований. Эта реакция носит название Реакция Фаворского или ацетилен-алленовой перегруппировки:
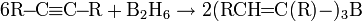
Реакции олигомеризации, полимеризации и циклообразования
Реакции олигомеризации
В присутствии солей меди и хлорида аммония в водной среде ацетилен вступает в реакцию олигомеризации с образованием винилацетилена:
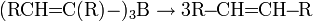
Реакция может идти дальше с образованием дивинилацетилена:
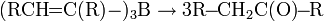
Реакция была впервые открыта Ю. Ньюлендом и служит первой промышленной стадией для синтеза хлоропрена.
Реакции полимеризации
Впервые полимеризацию ацетилена осуществил Дж. Натта в 1957 году, пропуская газ над раствором катализатора Al3-Ti4:
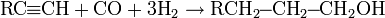
В ходе реакции был получен полукристаллический полиацетилен.
Полиацетилен интересен тем, что введением в него определенных добавок можно получить электропроводящий полимер с металлическими свойствами.
Реакции циклобразования
Ацетилен под действием катализаторов — раскалённого активированного угля при 500 °С или органоникелевого катализатора при 60 °С и повышенном давлении — достаточно легко циклотримеризуется, образуя бензол, а в других условиях в ТГФ) — циклооктатетраен:
Циклообразование в присутствии оксида углерода приводит к получению бензохинона:
Важной способностью алкинов является их возможность вступать в реакцию Дильса-Альдера:
Реакции образования гетероциклов
Образование производных пиррола
Взаимодействие ацетилена с оксимами кетонов в присутствии супероснования приводит к получению пиррольного кольца:

Гетероциклизация протекает при температуре 70—120 °С в среде диметилсульфоксида.
Существуют и альтернативные варианты синтеза:
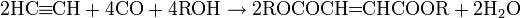
Образование производных фурана
При обработке алкинов водяным паром и CO в присутствии родиевого катализатора при давлении 10 МПа и 100 °C образуются производные фурана:
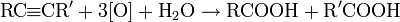
Образование прочих гетероциклов
Приведем ещё несколько примеров образования гетероциклов с использованием алкинов:
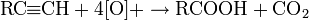
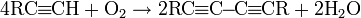
Просмотров: 43061
|
|