Химия - Алкины - Нахождение в природе и физиологическая роль алкинов
28 февраля 2011Оглавление:
1. Алкины
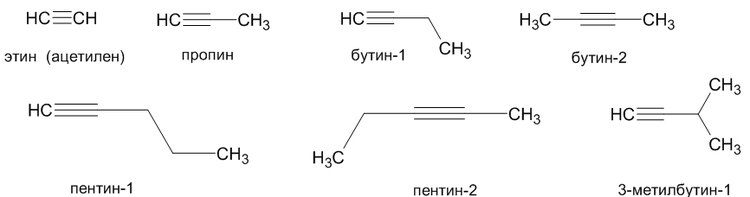
2. Номенклатура алкинов
3. Физические свойства
4. Нахождение в природе и физиологическая роль алкинов
5. Химические свойства
6. Идентификация алкинов
В природе алкины практически не встречаются. В некоторых видах грибов Basidiomycetes были обнаружены в крайне малом количестве соединения содержащие полиацетиленовые структуры.
Ацетилен обнаружен в атмосфере Урана, Юпитера и Сатурна.
Алкины обладают слабым наркозным действием. Жидкие алкины вызывают судороги.
Методы получения
Основным промышленным способом получения ацетилена является электро- или термокрекинг метана, пиролиз природного газа и карбидный метод.
Карбидный метод
Прокаливанием в электрических печах смеси оксида кальция с коксом при 1800—2000°С получают карбид кальция:
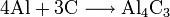
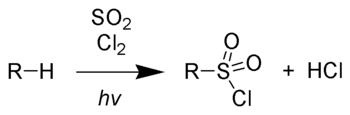
При действии на полученный карбид воды образуется гидроксид кальция и ацетилен:
Пиролиз углеводородов
Суть способа заключается в пропускании над специальной огнеупорной насадкой смеси природного газа с воздухом, который сгорая поднимает температуру до 1500 °C. Затем на насадке происходит пиролиз метана:
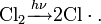
Крекинг природного газа
Электрокрекинг
Метод заключается в пропускании метана между двумя металлическими электродами с огромной скоростью. Температура 1500—1600°С. С химической точки зрения метод аналогичен методу пиролиза, отличаясь лишь технологическим и аппаратным исполнением.
Термоокислительный крекинг
В этом методе используется частичное окисление метана благодаря использованию теплоты, образующейся при его сгорании:
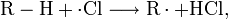
Метод прямого синтеза
Углерод напрямую взаимодействует с водородом при очень высоких температурах:
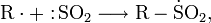
Этот метод имеет чисто историческое значение.
Электролиз солей непредельных карбоновых кислот
В 1864 году Кекуле получил ацетилен электролизом фумарата и малеата натрия:
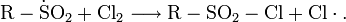
Аналогично получается ацетилен и из акрилата натрия.
Этот метод носит чисто историческое значение.
Дегидрогалогенирование галогеналканов и галогеналкенов
Реакция дегидрогалогенирования проводят действием сильного основания на дигалогеналканы:
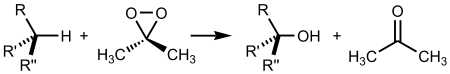
В качестве дегидрогалогенирующего агента удобно испрользовать амид натрия в жидком аммиаке :
Алкилирование алкинов
Алкилирование алкинов с концевой тройной связью производится по следующей схеме:

Подробнее смотри подраздел: Реакции нуклеофильного замещения алкинидов.
Прочие лабораторные способы получения алкинов
- Реакция Кори-Фукса — синтез алкинов из альдегидов:
На первой стадии идет образование дибромалкена:
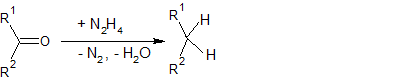
На второй стадии происходит отщепление брома:
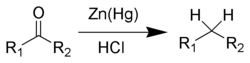
- Разложение дигидразонов:
- Перегруппировка Фрича-Буттенберга-Вихелля — превращение 1,1-диарил-2-дигалогенэтиленов в производные ацетилена под действием сильных оснований:
Просмотров: 43069
|
|