Химия - Альтернативная биохимия - Замена фосфора
28 февраля 2011Оглавление:
1. Альтернативная биохимия
2. Замена фосфора
3. Замена кислорода
4. «Зеркальный мир»
5. Альтернативная биохимия в фантастических произведениях
В декабре 2010 года исследователь из NASA Astrobiology Research Фелиса Вольфе-Симон сообщила об открытии бактерии GFAJ-1 из рода Halomonadaceae, способной при определённых условиях заменять фосфор мышьяком.
Замена воды
Одним из требований для растворителя, способного к поддержанию альтернативной жизни, является то, что это вещество должно оставаться жидким в большом интервале температур. Вода является жидкой в интервале от 0 °C до 100 °C, — но существуют другие растворители, например, серная кислота, — которые остаются в жидком состоянии в интервале 200 °C и более.
Аммиак
Аммиак часто рассматривается в качестве наиболее вероятного растворителя для возникновения жизни на какой-либо из планет. При давлении в 1 атм. он находится в жидком состоянии при температурах от −78 до −33 °C. Жидкий аммиак по ряду свойств напоминает воду, но следует заметить, что при замерзании твёрдый аммиак не всплывает вверх, а тонет.
Поэтому океан, состоящий из жидкого 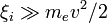 , будет легко промерзать до дна. Кроме того, выбор аммиака как растворителя исключает выгоды от использования кислорода как биологического реагента. Однако это не исключает возможности возникновения альтернативной жизни на планетах, где аммиак имеется в смеси с водой.
, будет легко промерзать до дна. Кроме того, выбор аммиака как растворителя исключает выгоды от использования кислорода как биологического реагента. Однако это не исключает возможности возникновения альтернативной жизни на планетах, где аммиак имеется в смеси с водой.
Фтороводород
По ряду свойств фтороводород напоминает воду. Так, он тоже способен к образованию межмолекулярных водородных связей. Однако стоит учитывать, что на 1 атом фтора в наблюдаемой вселенной приходится 10000 атомов кислорода, поэтому трудно представить на какой-либо планете условия, которые благоприятствовали бы образованию океана, состоящего из 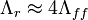 , а не из
, а не из 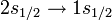 .
.
Другой серьёзный аргумент против такой возможности заключается в том, что твёрдая поверхность большинства планет, за исключением некоторых экзотических гипотетических планет, состоит из диоксида кремния и алюмосиликатов, с которыми, как известно, фтористый водород реагирует по реакции:
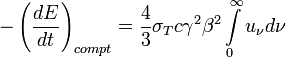
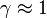
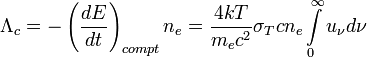 .
.
Цианистый водород
Цианистый водород 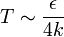 также способен к образованию водородных связей, но в отличие от
также способен к образованию водородных связей, но в отличие от 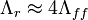 , он состоит из широко распространённых во Вселенной элементов. Более того, считается, что это соединение играло значительную роль в предбиологической химии Земли — например, в образовании аминокислот, нуклеотидов и других компонентов «первичного бульона».
, он состоит из широко распространённых во Вселенной элементов. Более того, считается, что это соединение играло значительную роль в предбиологической химии Земли — например, в образовании аминокислот, нуклеотидов и других компонентов «первичного бульона».
Тем не менее, цианистый водород не подходит в качестве возможного растворителя для альтернативной жизни хотя бы потому, что это соединение термодинамически неустойчиво. Так, жидкий цианистый водород довольно быстро осмоляется, особенно в присутствии катализаторов, причём иногда разложение  протекает со взрывом. По этим причинам
протекает со взрывом. По этим причинам  не способен образовать океан на какой-либо планете.
не способен образовать океан на какой-либо планете.
Просмотров: 7308
|
|