Химия - Атом - Свойства
01 марта 2011Оглавление:
1. Атом
2. Модели атомов
3. Квантово-механическая модель атома
4. Строение
5. Свойства
По определению, любые два атома с одним и тем же числом протонов в их ядрах относятся к одному химическому элементу. Атомы с одним и тем же количеством протонов, но разным количеством нейтронов называют изотопами данного элемента. Например, атомы водорода всегда содержат один протон, но существуют изотопы без нейтронов, с одним нейтроном и двумя нейтронами. Известные элементы составляют непрерывный натуральный ряд по числу протонов в ядре, начиная с атома водорода с одним протоном и заканчивая атомом унуноктия, в ядре которого 118 протонов. Все изотопы элементов периодической системы, начиная с номера 83, радиоактивны.
Масса
Поскольку наибольший вклад в массу атома вносят протоны и нейтроны, полное число этих частиц называют массовым числом. Массу покоя атома часто выражают в атомных единицах массы, которая также называется дальтоном. Эта единица определяется как ⁄12 часть массы покоя нейтрального атома углерода-12, которая приблизительно равна 1,66×10 г. Водород-1 — наилегчайший изотоп водорода и атом с наименьшей массой, имеет атомный вес около 1,007825 а. е. м. Масса атома приблизительно равна произведению массового числа на атомную единицу массы. Самый тяжёлый стабильный изотоп — свинец-208 с массой 207,9766521 а. е. м.
Так как массы даже самых тяжёлых атомов в обычных единицах очень малы, то в химии для измерения этих масс используют моли. В одном моле любого вещества по определению содержится одно и то же число атомов. Это число выбрано таким образом, что если масса элемента равна 1 а. е. м., то моль атомов этого элемента будет иметь массу 1 г. Например, углерод имеет массу 12 а. е. м., поэтому 1 моль углерода весит 12 г.
Размер
Атомы не имеют отчётливо выраженной внешней границы, поэтому их размеры определяются по расстоянию между ядрами соседних атомов, которые образовали химическую связь или по расстоянию до самой дальней из стабильных орбит электронов в электронной оболочке этого атома. Радиус зависит от положения атома в периодической системе, вида химической связи, числа ближайших атомов и квантово-механического свойства, известного как спин. В периодической системе элементов размер атома увеличивается при движении сверху вниз по столбцу и уменьшается при движении по строке слева направо. Соответственно, самый маленький атом — это атом гелия, имеющий радиус 32 пм, а самый большой — атом цезия. Эти размеры в тысячи раз меньше длины волны видимого света, поэтому атомы нельзя увидеть в оптический микроскоп. Однако отдельные атомы можно наблюдать с помощью сканирующего туннельного микроскопа.
Малость атомов демонстрируют следующие примеры. Человеческий волос по толщине в миллион раз больше атома углерода. Одна капля воды содержит 2 секстиллиона атомов кислорода, и в два раза больше атомов водорода. Один карат алмаза с массой 0,2 г состоит из 10 секстиллионов атомов углерода. Если бы яблоко можно было увеличить до размеров Земли, то атомы достигли бы исходных размеров яблока.
Учёные из Харьковского физико-технического института представили первые в истории науки снимки атома. Для получения снимков учёные использовали электронный микроскоп, фиксирующий излучения и поля. Физики последовательно разместили десятки атомов углерода в вакуумной камере и пропустили через них электрический разряд в 425 вольт. Излучение последнего атома в цепочке на фосфорный экран позволило получить изображение облака электронов вокруг ядра.
Радиоактивный распад

У каждого химического элемента есть один или более изотопов с нестабильными ядрами, которые подвержены радиоактивному распаду, в результате чего атомы испускают частицы или электромагнитное излучение. Радиоактивность возникает, когда радиус ядра больше радиуса действия сильных взаимодействий.
Существуют три основные формы радиоактивного распада:
- Альфа-распад происходит, когда ядро испускает альфа-частицу — ядро атома гелия, состоящее из двух протонов и двух нейтронов. В результате испускания этой частицы возникает элемент с меньшим на два атомным номером.
- Бета-распад происходит из-за слабых взаимодействий, и в результате нейтрон превращается в протон или наоборот. В первом случае происходит испускание электрона и антинейтрино, во втором — испускание позитрона и нейтрино. Электрон и позитрон называют бета-частицами. Бета-распад увеличивает или уменьшает атомный номер на единицу.
- Гамма-излучение происходит из-за перехода ядра в состояние с более низкой энергией с испусканием электромагнитного излучения. Гамма-излучение может происходить вслед за испусканием альфа- или бета-частицы после радиоактивного распада.
Каждый радиоактивный изотоп характеризуется периодом полураспада, то есть временем, за которое распадается половина ядер образца. Это экспоненциальный распад, который вдвое уменьшает количество оставшихся ядер за каждый период полураспада. Например, по прошествии двух периодов полураспада в образце останется только 25 % ядер исходного изотопа.
Магнитный момент
Элементарные частицы обладают внутренним квантовомеханическим свойством известным как спин. Оно аналогично угловому моменту объекта вращающегося вокруг собственного центра масс, хотя строго говоря, эти частицы являются точечными и нельзя говорить об их вращении. Спин измеряют в единицах приведённой планковской постоянной, тогда электроны, протоны и нейтроны имеют спин равный ½ 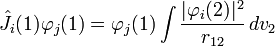 . В атоме электроны обращаются вокруг ядра и обладают орбитальным угловым моментом помимо спина, в то время как ядро само по себе имеет угловой момент благодаря ядерному спину.
. В атоме электроны обращаются вокруг ядра и обладают орбитальным угловым моментом помимо спина, в то время как ядро само по себе имеет угловой момент благодаря ядерному спину.
Магнитное поле, создаваемое магнитным моментом атома, определяется этими различными формами углового момента, как и в классической физике вращающиеся заряженные объекты создают магнитное поле. Однако, наиболее значительный вклад происходит от спина. Благодаря свойству электрона, как и всех фермионов, подчиняться правилу запрета Паули, по которому два электрона не могут находиться в одном и том же квантовом состоянии, связанные электроны спариваются друг с другом, и один из электронов находится в состоянии со спином вверх, а другой — с противоположной проекцией спина — состояние со спином вниз. Таким образом магнитные моменты электронов сокращаются, уменьшая полный магнитный дипольный момент системы до нуля в некоторых атомах с чётным числом электронов.
В ферромагнитных элементах, таких как железо, нечётное число электронов приводит к появлению неспаренного электрона и к ненулевому полному магнитному моменту. Орбитали соседних атомов перекрываются, и наименьшее энергетическое состояние достигается, когда все спины неспаренных электронов принимают одну ориентацию, процесс известный как обменное взаимодействие. Когда магнитные моменты ферромагнитных атомов выравниваются, материал может создавать измеримое макроскопическое магнитное поле. Парамагнитные материалы состоят из атомов, магнитные моменты которых разориентированы в отсутствии магнитного поля, но магнитные моменты отдельных атомов выравниваются при приложении магнитного поля.
Ядро атома тоже может обладать ненулевым полным спином. Обычно при термодинамическом равновесии спины ядер ориентированы случайным образом. Однако, для некоторых элементов возможно поляризовать значительную часть ядерных спинов для создания состояния с сонаправленными спинами —состояния называемого гиперполяризацией. Это состояние имеет важное прикладное значение в магнитно-резонансной томографии.
Энергетические уровни
Когда электрон находится в связанном состоянии в атоме, он обладает потенциальной энергией, которая обратно пропорциональна его расстоянию от ядра. Эта энергия обычно измеряется в электронвольтах и равна энергии, которую надо передать электрону, чтобы сделать его свободным. Согласно квантовомеханической модели атома связанный электрон может занимать только дискретный набор разрешённых энергетических уровней — состояний с определённой энергией. Наинизшее из разрешённых энергетических состояний называется основным, а все остальные — возбуждёнными.
Для перехода электрона с одного энергетического уровня на другой нужно передать ему или отнять у него энергию. Это происходит путём соответственно поглощения или испускания фотона, причём энергия этого фотона равна абсолютной величине разности энергий начального и конечного уровней электрона. Энергия испущенного фотона пропорциональна его частоте, поэтому переходы между разными энергетическими уровнями проявляются в различных областях электромагнитного спектра. Каждый элемент имеет уникальный спектр испускания, который зависит от заряда ядра, заполнения электронных подоболочек, взаимодействия электронов, а также других факторов.

Когда излучение с непрерывным спектром проходит через вещество, некоторые фотоны поглощаются атомами или ионами, вызывая электронные переходы между энергетическим состояниями, разность энергий которых равна энергии поглощённого фотона. Затем эти возбуждённые электроны спонтанно переходят на уровень, лежащий ниже по энергии, снова испуская фотоны. Таким образом, вещество ведёт себя как фильтр, превращая исходный непрерывный спектр в спектр поглощения, в котором имеются серии тёмных полос. При наблюдении с тех углов, куда не направлено исходное излучение, можно заметить излучение с эмиссионным спектром, испускаемое атомами. Спектроскопические измерения энергии, амплитуды и ширины спектральных линий излучения позволяют определить вид излучающего вещества и физические условия в нём.
Более детальный анализ спектральных линий показал, что некоторые из них обладают тонкой структурой, то есть расщеплены на несколько близких линий. В узком смысле «тонкой структурой» спектральных линий принято называть их расщепление, происходящее из-за спин-орбитального взаимодействия между спином и вращательным движением электрона.
Взаимодействие магнитных моментов электрона и ядра приводит к сверхтонкому расщеплению спектральных линий, которое, как правило, меньше, чем тонкое.
Если поместить атом во внешнее магнитное поле, то также можно заметить расщепление спектральных линий на две, три и более компонент — это явление называется эффектом Зеемана. Он вызван взаимодействием внешнего магнитного поля с магнитным моментом атома, при этом в зависимости от взаимной ориентации момента атома и магнитного поля энергия данного уровня может увеличиться или уменьшиться. При переходе атома из одного расщеплённого состояния в другое будет излучаться фотон с частотой, отличной от частоты фотона при таком же переходе в отсутствие магнитного поля. Если спектральная линия при помещении атома в магнитное поле расщепляется на три линии, то такой эффект Зеемана называется нормальным. Гораздо чаще в слабом магнитном поле наблюдается аномальный эффект Зеемана, когда происходит расщепление на 2, 4 или более линий. При увеличении магнитного поля вид расщепления упрощается, и аномальный эффект Зеемана переходит в нормальный. Присутствие электрического поля также может вызвать сравнимый по величине сдвиг спектральных линий, вызванный изменением энергетических уровней. Это явление известно как эффект Штарка.
Если электрон находится в возбуждённом состоянии, то взаимодействие с фотоном определённой энергии может вызвать вынужденное излучение дополнительного фотона с такой же энергией — для этого должен существовать более низкий уровень, на который возможен переход, и разность энергий уровней должна равняться энергии фотона. При вынужденном излучении эти два фотона будут двигаться в одном направлении и иметь одинаковую фазу. Это свойство используется в лазерах, которые могут испускать когерентный пучок света в узком диапазоне частот.
Валентность
Внешняя электронная оболочка атома, если она не полностью заполнена, называется валентной оболочкой, а электроны этой оболочки называются валентными электронами. Число валентных электронов определяет то, как атом связывается с другими атомами посредством химической связи. Путём образования химических связей атомы стремятся заполнить свои внешние валентные оболочки.
Чтобы показать повторяющиеся химические свойства химических элементов, их упорядочивают в виде периодической таблицы. Элементы с одинаковым числом валентных электронов формируют группу, которая изображается в таблице в виде столбца. Элементы, находящиеся в самом правом столбце таблицы, имеют полностью заполненную электронами внешнюю оболочку, поэтому они отличаются крайне низкой химической активностью и называются инертными или благородными газами.
Просмотров: 8766
|
|