Химия - Атомная орбиталь - Геометрическое представление
28 февраля 2011Оглавление:
1. Атомная орбиталь
2. Геометрическое представление
3. Заполнение орбиталей электронами и электронная конфигурация атома
Геометрическое представление атомной орбитали — область пространства, ограниченная поверхностью равной плотности вероятности или заряда. Плотность вероятности на граничной поверхности выбирают исходя из решаемой задачи, но, обычно, таким образом, чтобы вероятность нахождения электрона в ограниченной области лежала в диапазоне значений 0,9-0,99.
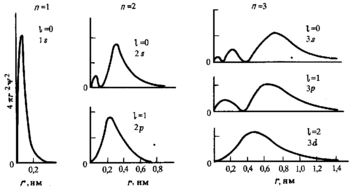
Поскольку энергия электрона определяется кулоновским взаимодействием и, следовательно, расстоянием от ядра, то главное квантовое число n задаёт размер орбитали.
Форма и симметрия орбитали задаются орбитальным квантовыми числами l и m: s-орбитали являются сферически симметричными, p, d и f-орбитали имеют более сложную форму, определяемую угловыми частями волновой функции — угловыми функциями. Угловые функции Ylm — собственные функции оператора квадрата углового момента L², зависящие от квантовых чисел l и m, являются комплексными и описывают в сферических координатах угловую зависимость вероятности нахождения электрона в центральном поле атома. Линейная комбинация этих функций определяет положение орбиталей относительно декартовых осей координат.
Для линейных комбинаций Ylm приняты следующие обозначения:
| Значение орбитального квантового числа | 0 | 1 | 1 | 1 | 2 | 2 | 2 | 2 | 2 |
|---|---|---|---|---|---|---|---|---|---|
| Значение магнитного квантового числа | 0 | 0 |  |
 |
0 |  |
 |
 |
 |
| Линейная комбинация | - | - |  |
 |
- |  |
 |
 |
 |
| Обозначение |  |
 |
 |
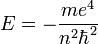 |
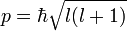 |
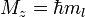 |
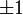 |
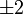 |
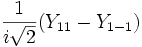 |
Дополнительным фактором, иногда учитываемым в геометрическом представлении, является знак волновой функции. Этот фактор существеннен для орбиталей с орбитальным квантовым числом l, отличным от нуля, то есть не обладающих сферической симметрией: знак волновой функции их «лепестков», лежащих по разные стороны узловой плоскости, противоположен. Знак волновой функции учитывается в методе молекулярных орбиталей МО ЛКАО.
Просмотров: 4265
|
|