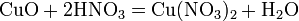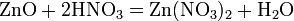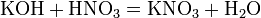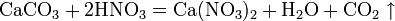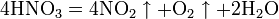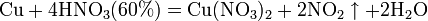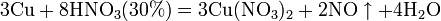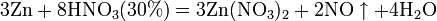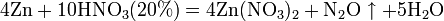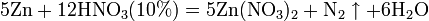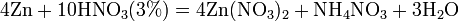Химия - Азотная кислота - Химические свойства
01 марта 2011Оглавление:
1. Азотная кислота
2. Химические свойства
3. Исторические сведения
4. Промышленное производство, применение и действие на организм
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять только при пониженном давлении.
Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией.
HNO3 как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:
б) с основаниями:
в) вытесняет слабые кислоты из их солей:
При кипении или под действием света азотная кислота частично разлагается:
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
Концентрированная HNO3
Разбавленная HNO3
б) с металлами, стоящими в ряду напряжений левее водорода:
Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой в продуктах будет содержаться больше всего NO, но также будут содержаться и NO2, N2O, N2 и NH4NO3.
Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
- увеличение концентрации кислоты
 увеличение активности металла
увеличение активности металла
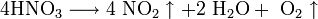
С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
и сложные вещества, например:
Некоторые органические соединения самовоспламеняются при контакте с концентрированной азотной кислотой.

Некоторые металлы, реагирующие с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и устойчивы к её воздействию.
Смесь азотной и серной кислот носит название «меланж». Благодаря наличию амила достигается концентрация в 104%.
Азотная кислота широко используется для получения нитросоединений.
Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила:
Нитраты
HNO3 — сильная кислота. Её соли — нитраты — получают действием HNO3 на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде.
Соли азотной кислоты — нитраты — при нагревании необратимо разлагаются, продукты разложения определяются катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния:
2NaNO3 = 2NaNO2 + O2
б) нитраты металлов, расположенных в ряду напряжений между магнием и медью:
4Al3 = 2Al2O3 + 12NO2 + 3O2
в) нитраты металлов, расположенных в ряду напряжений правее ртути:
2AgNO3 = 2Ag + 2NO2 + O2
г) нитрат аммония:
NH4NO3 = N2O + 2H2O
Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твердом состоянии нитраты — сильные окислители, например:
Fe + 3KNO3 + 2KOH = K2FeO4 + 3KNO2 + H2O — при сплавлении твердых веществ.
Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH3:
Соли азотной кислоты — нитраты — широко используются как удобрения. При этом практически все нитраты хорошо растворимы в воде, поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская селитра и индийская селитра. Большинство нитратов получают искусственно.
С азотной кислотой не реагируют стекло, фторопласт-4.
Просмотров: 6910
|
|