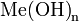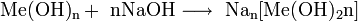Химия - Бромная кислота
01 марта 2011Бромная кислота — сильная кислота, имеющая состав HBrO4. Получена в 1964 г. окислением броматов дифторидом ксенона. Соли кислоты — перброматы. В чистом виде не выделена, хотя получены концентрированные растворы.
Получение
Окисление бромноватой кислоты дифторидом ксенона:
Окислением броматов фтором с последующей обработкой кислотой:
Физические свойства
Бромная кислота существует только в водном растворе, максимальная концентрация 83 %вес, стабильна в концентрации до 55 %. Практически не перегоняется в вакууме.
При охлаждении водных растворов бромной кислоты из них выпадает кристаллогидрат HBrO4·2H2O.
Химические свойства
При нагревании, а при повышении концентрации даже при комнатной температуре, бромная кислота разлагается:
Бромная кислота является сильной одноосновной кислотой:
Бромная кислота — сильный окислитель:
Просмотров: 2228
|
|