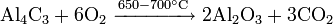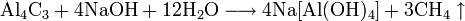Химия - Бромоводород
01 марта 2011Оглавление:
1. Бромоводород
2. Химические свойства
Бромоводород — соединение брома с водородом. Бесцветный газ, обильно испускает дым при содержании на воздухе.
Получение
В промышленности бромоводород получают непосредственным взаимодействием элементов:
так же бромистый водород получается как побочный продукт при синтезе бромпроизводных органических соединений
В лаборатории получают гидролизом трибромида или пентабромида фосфора:
Восстановление брома несколькими способами:
Вытеснение из бромидов щелочных металлов разбавленной кислотой:
Физические свойства
Бромистый водород это бесцветный газ с резким запахом, сильно дымящийся на воздухе. Термически очень устойчив.
Хорошо растворим в воде: 221 г/100 г воды при 0 °C. Водный раствор образует азеотропную смесь с 47,63% HBr, которая кипит при 124,3 °C.
Растворяется в этаноле, образуя слабый электролит.
При охлаждении водных растворов HBr можно получить кристаллогидраты:
- HBr·H2O — устойчив при -15,5÷-3,3 °C
- HBr·2H2O — плавится при −11,2 °C
- HBr·4H2O — плавится при −55,8 °C
Чистый HBr образует кристаллы орторомбической сингонии, пространственная группа F mmm, параметры при −173 °C a = 0,5640 нм, b = 0,6063 нм, c = 0,5555 нм, Z = 4.
Просмотров: 4825
|
|