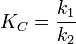Химия - Эбулиоскопия
28 февраля 2011Скребковый конвейер почему так важны скребковые.
Эбулиоскопия — метод исследования растворов, основанный на измерении повышения их температуры кипения по сравнению с чистым растворителем. Используется для определения молекулярной массы растворенного вещества, активности растворителя, степени диссоциации.
Температура кипения жидкости — такая температура, при которой давление пара над жидкостью равно внешнему давлению. В то же время давление пара над раствором нелетучего вещества практически полностью определяется давлением пара растворителя и, в соответствии с законом Рауля, может быть выражено уравнением:
- где x1 — мольная доля растворителя.
Видно, что при повышении концентрации растворенного вещества давление пара над раствором будет снижаться, а следовательно, при неизменном внешнем давлении, будет расти температура кипения.
С учетом уравнения Клапейрона — Клаузиуса можно показать, что изменение температуры кипения раствора может быть рассчитано по формуле:
- где ΔHboil — энтальпия испарения;
- M1 — молярная масса растворителя;
- n2 — моляльная концентрация растворенного вещества.
Дробь в квадратных скобках в этом выражении зависит только от свойств растворителя — это так называемая эбулиоскопическая константа растворителя 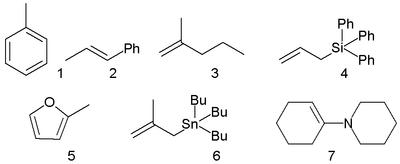 . Она равна повышению температуры кипения одномоляльного раствора.
. Она равна повышению температуры кипения одномоляльного раствора.
Если известны изменение температуры кипения и концентрация раствора, можно определить молярную массу растворенного вещества:
- где a — число грамм растворенного вещества на 1000 г растворителя. Этот метод применим для разбавленных растворов нелетучих веществ и неэлектролитов.
Эбулиоскопический метод позволяет судить о состоянии вещества в растворах электролитов, так как для последних:
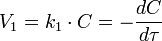 ;
;
где i — изотонический коэффициент.
С помощью эбулиоскопии можно определить и активность растворителя, в соответствии с формулой:
Просмотров: 2583
|
|