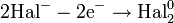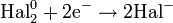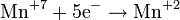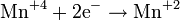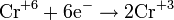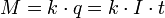Химия - Электролиз - Первый закон Фарадея
01 марта 2011Оглавление:
1. Электролиз
2. Первый закон Фарадея
3. Изменение электролизом веществ
4. Примеры
5. Мнемоническое правило
6. Интересный факт
В 1832 году Фарадей установил, что масса M вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:

если через электролит пропускается в течение времени t постоянный ток с силой тока I. Коэффициент пропорциональности 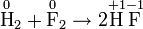 называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Вывод закона Фарадея
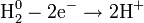
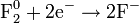
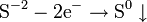
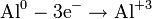
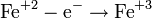 , где z — валентность атома вещества, e — заряд электрона
, где z — валентность атома вещества, e — заряд электрона
Подставляя- в, получим
где 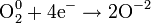 — постоянная Фарадея.
— постоянная Фарадея.
Второй закон Фарадея
Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты.
Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
где 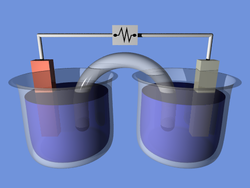 — постоянная Фарадея.
— постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
где 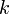 — молярная масса данного вещества, образовавшегося в результате электролиза,
— молярная масса данного вещества, образовавшегося в результате электролиза, 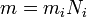 — сила тока, пропущенного через вещество или смесь веществ,
— сила тока, пропущенного через вещество или смесь веществ, 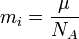 — время, в течение которого проводился электролиз,
— время, в течение которого проводился электролиз,  — постоянная Фарадея,
— постоянная Фарадея, 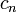 — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона, принявшего непосредственное участие в электролизе. Однако это не всегда так; например, при электролизе раствора соли меди может образовываться не только свободная медь, но и ионы меди.
— число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона, принявшего непосредственное участие в электролизе. Однако это не всегда так; например, при электролизе раствора соли меди может образовываться не только свободная медь, но и ионы меди.
Просмотров: 8935
|
|