Химия - Энергия сродства к электрону
28 февраля 2011Энергией сродства атома к электрону, или просто его сродством к электрону, называют энергию, выделяющуюся в процессе присоединения электрона к свободному атому Э в его основном состоянии с превращением его в отрицательный ион Э.
- Э + e = Э + ε
Сродство к электрону выражают в килоджоулях на моль или в электронвольтах на атом.
В отличие от ионизационного потенциала атома, имеющего всегда эндоэнергетическое значение, сродство атома к электрону описывается как экзоэнергетическими, так и эндоэнергетическими значениями.
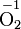
| Элемент | ε | Элемент | ε | Элемент | ε |
|---|---|---|---|---|---|
| H | -0,75 | Na | -0,78 | K | -0,92 |
| He | 0,30 | Mg | 0,32 | Ca | 0,40 |
| Li | -0,58 | Al | -0,52 | Sc | 0,14 |
| Be | 0,19 | Si | -1,39 | Ti | -0,40 |
| B | -0,33 | P | -0,78 | V | -0,94 |
| C | -1,12 | S | -2,07 | Cr | -0,98 |
| N | 0,27 | Cl | -3,61 | Mn | 1,07 |
| О | -1,47 | Br | -3,36 | Fe | -0,58 |
| F | -3,45 | I | -3,06 | Co | -0,94 |
| Ne | 0,55 | Ni | -1,28 | ||
| Cu | -1,80 |
Наибольшим сродством к электрону обладают p-элементы VII группы. Наименьшее сродство к электрону у атомов с конфигурацией s и sp или с наполовину заполненными p-орбиталями:
| Li | Be | B | C | N | O | F | Ne | |
|---|---|---|---|---|---|---|---|---|
| Электронная конфигурация | s | s | sp | sp | sp | sp | sp | sp |
| ε, эВ | -0,59 | 0,19 | -0,30 | -1,27 | 0,21 | -1,47 | -3,45 | 0,22 |
Небольшие расхождения в цифрах между табл. 1 и табл. 2 обусловлены тем, что данные взяты из разных источников, а также погрешностью измерений.
Просмотров: 3147
|
|