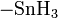Химия - Фосфин
01 марта 2011Оглавление:
1. Фосфин
2. Химические свойства
Фосфин — бесцветный, очень ядовитый, довольно неустойчивый газ со специфическим запахом гнилой рыбы.
Физические свойства
Бесцветный газ. Плохо растворяется в воде, не реагирует с ней. При низких температурах образует твердый клатрат 8РН3·46Н2О. Растворим в бензоле, диэтиловом эфире, сероуглероде. При −133,8 °C образует кристаллы с гранецентрированной кубической решёткой.
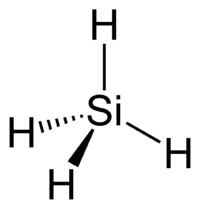
Молекула фосфина имеет форму тригональной пирамиды c молекулярной симметрией C3v. Дипольный момент составляет 0,58 D, существенно ниже, чем у аммиака. Водородная связь между молекулами PH3 практически не проявляется и поэтому фосфин имеет более низкие температуры плавления и кипения.
Получение
Получают фосфин при взаимодействии белого фосфора с горячей щёлочью, например:
Также его можно получить воздействием воды или кислот на фосфиды:
Возможен синтез непосредственно из элементов:
Хлористый водород при нагревании взаимодействует с белым фосфором:
Разложение йодида фосфония:
Разложение фосфоновой кистоты:
или её восстановление:
Просмотров: 6327
|
|