Химия - Фосфорные кислоты
28 февраля 2011соединения фосфора в степени окисления +5, имеющие общую формулу P2O5·nH2O.
При взаимодействии высшего оксида фосфора с водой на холоде получается метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу. При разбавлении её водой образуется ортофосфорная кислота H3PO4:
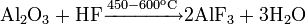
При нагревании до 200—250 °C ортофосфорная кислота обезвоживается, и образуется пирофосфорная кислота H4P2O7, в результате дальнейшей дегидратации которой при 400—500 °C вновь образуется метафосфорная кислота:
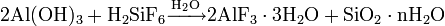
Из всех фосфорных кислот наибольшее практическое значение имеет ортофосфорная кислота. Для её получения используют реакции обмена фосфатов с сильными кислотами или окисление белого фосфора азотной кислотой:
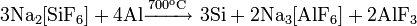
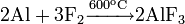
Фосфорную кислоту и её соли широко используют при производстве минеральных удобрений. Наиболее распространёнными фосфорными удобрениями являются простой суперфосфат, преципитат и фосфоритная мука.
Просмотров: 1922
|
|