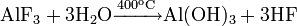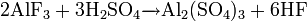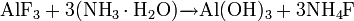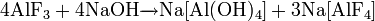Химия - Фторид кальция
28 февраля 2011Оглавление:
1. Фторид кальция
2. Химические свойства
3. Опасность применения
Физические свойства
Бесцветные диамагнитные кристаллы. До температуры 1151 °C существует α-CaF2 с кубической решеткой, выше 1151 °C — разупорядоченная модификация тетрагональной сингонии, температура плавления у этой модификации — 1418 °C.
Плохо растворим в воде.
Получение
В природе CaF2 встречается в виде минерала флюорита, который содержит до 90-95 % CaF2 и 3,5-8 % SiO2. Это хрупкий и мягкий минерал с большой вариацией в цвете: бесцветный, белый, желтый, оранжевый, красный, бурый, зеленый, зеленовато-голубой, фиолетово-синий, серый, пурпурный, синевато-черный, розовый и малиновый. Окраска связана с примесями хлора, железа, урана, дефектами кристаллической структуры, которая весьма тонко реагирует на нагревание. Является основным источником фтора в мире. Мировое производство ~4,5 млн т/год.
В лабораторных условиях фторид кальция обычно получают из карбоната кальция и плавиковой кислоты:
Чисто теоретический интерес представляет способ получения непосредственно из простых веществ:
Разбавленная плавиковая кислота взаимодействует с оксидом кальция:
Фторид кальция можно получить обменными реакциями, например:
Просмотров: 4172
|
|