Химия - Галогеноводороды
28 февраля 2011Оглавление:
1. Галогеноводороды
2. Химические свойства
3. Методы получения
общее название соединений, образованных из водорода и галогенов:
- Плавиковая кислота — водный раствор фтороводорода
- Соляная кислота — водный раствор хлороводорода
- Бромоводородная кислота — водный раствор бромоводорода
- Иодоводородная кислота — водный раствор иодоводорода
Все галогеноводороды — бесцветные газы с резким запахом, хорошо растворимые в воде. На воздухе их концентрированные растворы дымят вследствие выделения галогеноводородов.
Сокращённо галогеноводороды обозначают НГ, а в источниках на языках, использующих латинский алфавит, — HHal.
| соединение | формула | модель | атомная масса | длина связи d/pm |
дипольный момент μ/D |
ΔG°f | tплав °C |
tкип °C |
|---|---|---|---|---|---|---|---|---|
|
|
|
|
|
|
|
|
|
|
|
|
|
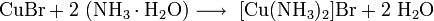 |
|
|
|
|
|
|
|
|
|
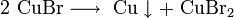 |
|
|
|
|
|
|
|
|
|
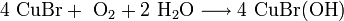 |
|
|
|
|
|
|
В ряду HCl — HBr — HI в соответствии с увеличением ковалентности связи уменьшается дипольный момент молекулы: соответственно 0,33 ×10, 0,26×10 и 0,19×10 Кл·м. В жидкой и газовой фазах молекулы HCl, HBr, HI, в отличие от HF, не ассоциированы. Прочность связи в ряду HCl — HBr — HI значительно уменьшается, поскольку уменьшается степень перекрывания взаимодействующих электронных облаков. Также уменьшается и их устойчивость к нагреванию.
В ряду HCl — HBr — HI закономерно изменяются температуры плавления и кипения, но при переходе к HF они резко возрастают. Это объясняется ассоциацией молекул фтороводорода в результате образования водородных связей.
Просмотров: 5816
|
|