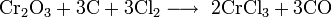Химия - Гидрид алюминия - Физические свойства
28 февраля 2011Оглавление:
1. Гидрид алюминия
2. Физические свойства
3. Получение
4. Применение
Гидрид алюминия представляет собой твёрдое белое или бесцветное вещество. Плотность 1,45 г/см³. Растворим в тетрагидрофуране.
Термодинамические константы:
- стандартная энтальпия образования, ΔH298: −12 кДж/моль;
- стандартная энтропия, S298: 30 Дж/);
- стандартная энергия Гиббса, ΔG298: 46 кДж/моль.
Большое содержание водорода в гидриде алюминия обуславливает ряд его свойств, связанных с проблемой высокотемпературной сверхпроводимости: в области давлений ~60 ГПа и температуре ~1000 K он обладает полупроводниковым механизмом проводимости, а в области высоких давлений и температур его проводимость сопоставима с металлической электропроводностью водорода.
Химические свойства
- Соединение нестабильно: при нагревании выше 100 °C разлагается:
- Бурно взаимодействует с водой:
- С диэтиловым эфиром образует высокореакционный, но относительно стабильный комплекс переменного состава, который часто используется для синтетических целей:
- Аналогичный комплекс образуется с другими низшими алифатическими эфирами, а также с триметиламином: AlH3 • N3. Последний взаимодействует с водой со взрывом.
- Для стабилизации гидрида алюминия также можно использовать комплексы с другими аминами, например с N-метилпирролидином: AlH3 • NMP и AlH3 • 2.
- Гидрид алюминия — очень сильный восстановитель. Он способен восстановить углекислый газ до метана:
- Известны многочисленные реакции восстановления органических соединений с использованием гидрида алюминия.
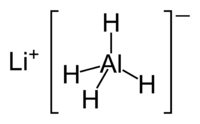
- Взаимодействует с гидридом лития, образуя алюмогидрид:
- Медленно вступает в реакцию с дибораном, образуя борогидрид алюминия:
Просмотров: 5876
|
|