Химия - Гидролиз
01 марта 2011Оглавление:
1. Гидролиз
2. Гидролиз органических веществ
Гидролиз — один из видов химических реакций сольволиза, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений. Механизм гидролиза соединений различных классов: соли, углеводы, белки, сложные эфиры, жиры и др. имеет существенные различия.
Гидролиз солей
Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или молекулярном виде.
Различают обратимый и необратимый гидролиз солей:
- 1. Гидролиз соли слабой кислоты и сильного основания:
CO3 + H2O = HCO3 + OH
Na2CO3 + Н2О = NaHCO3 + NaOH
- 2. Гидролиз соли сильной кислоты и слабого основания:
Cu + Н2О = CuOH + Н
CuCl2 + Н2О = CuOHCl + HCl
- 3. Гидролиз соли слабой кислоты и слабого основания:
2Al + 3S + 6Н2О = 2Al3 + ЗН2S
Al2S3 + 6H2O = 2Al3 + 3H2S
.
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален. См. также Электролитическая диссоциация.
Степень гидролиза
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α;
α =·100 %
где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза
Константа гидролиза — константа равновесия гидролитической реакции.
Выведем уравнение константы гидролиза соли, образованной слабой кислотой и сильным основанием:
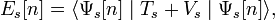
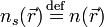
Уравнение константы равновесия для данной реакции будет иметь вид:
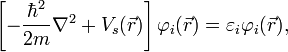 или
или 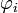
Так как концентрация молекул воды в растворе постоянна, то произведение двух постоянных 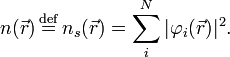 можно заменить одной новой — константой гидролиза:
можно заменить одной новой — константой гидролиза:
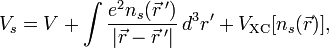
Численное значение константы гидролиза получим, используя ионное произведение воды 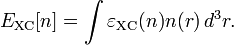 и константу диссоциации азотистой кислоты
и константу диссоциации азотистой кислоты 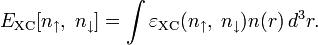 :
:
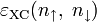
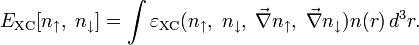
подставим в уравнение константы гидролиза равна:

В общем случае для соли, образованной слабой кислотой и сильным основанием:
 , где Ka — константа диссоциации слабой кислоты, образующейся при гидролизе
, где Ka — константа диссоциации слабой кислоты, образующейся при гидролизе
для соли, образованной сильной кислотой и слабым основанием:
 , где Kb — константа диссоциации слабого основания, образующегося при гидролизе
, где Kb — константа диссоциации слабого основания, образующегося при гидролизе
для соли, образованной слабой кислотой и слабым основанием:

Просмотров: 7231
|
|