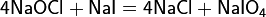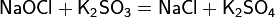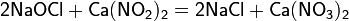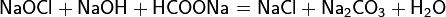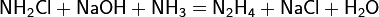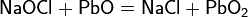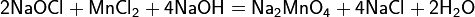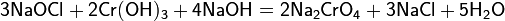Химия - Гипохлорит натрия - Лабораторные методы получения
28 февраля 2011Оглавление:
1. Гипохлорит натрия
2. История открытия
3. Физические свойства
4. Химические свойства
5. Идентификация
6. Коррозионное воздействие
7. Физиологическое действие и воздействие на окружающую среду
8. Лабораторные методы получения
9. Применение
Основным лабораторным методом получения гипохлорита натрия является пропускание газообразного хлора через охлаждённый насыщенный раствор гидроксида натрия:
Для отделения из реакционной смеси хлорида натрия используют охлаждение до температуры близкой к 0 °C — в этих условиях соль выпадает в осадок. Дальнейшим замораживанием смеси и последующей кристаллизацией при −5 °C получают пентагидрат гипохлорита натрия NaOCl · 5H2O. Безводную соль можно получить обезвоживанием в вакууме над концентрированной серной кислотой.
Вместо гидроксида для синтеза можно взять карбонат натрия:
Водный раствор гипохлорита натрия можно получить обменной реакцией карбоната натрия с гипохлоритом кальция:
Промышленное производство
Мировое производство
Оценка мирового объёма производства гипохлорита натрия представляет определённую трудность в связи с тем, что значительная его часть производится электрохимическим способом по принципу «in situ», т. е. на месте его непосредственного потребления. По данным на 2005 год, приблизительный глобальный объём производства NaOCl составил около 1 млн тонн, при этом почти половина этого объёма было использовано для бытовых, а другая половина — для промышленных нужд.
Обзор промышленных способов получения
Выдающиеся отбеливающие и дезинфекционные свойства гипохлорита натрия привели к интенсивному росту его потребления, что в свою очередь дало стимул для создания крупномасштабных промышленных производств.
В современной промышленности существует два основных метода производства гипохлорита натрия:
- химический метод — хлорирование водных растворов гидроксида натрия;
- электрохимический метод — электролиз водного раствора хлорида натрия.
В свою очередь, способ химического хлорирования, предлагает две производственные схемы:
- основной процесс, где в качестве конечного продукта образуется разбавленный раствор гипохлорита с примесью хлорида и гидроксида натрия;
- низко-солевой или концентрированный процесс — позволяет получить концентрированный с меньшим уровнем загрязнения.
Химический метод
Сущность химического метода получения NaOCl не изменилась с момента его открытия Лабарраком:
Современный химический гигант Dow Chemical Company был одной из первых компаний, поставивших производство гипохлорита натрия на масштабную промышленную основу. В 1898 году открылся первый завод компании по выпуску NaOCl химическим способом. Другой компанией, благодаря которой, это вещество достигло сегодняшней популярности, стала Clorox — крупнейший производитель бытовых отбеливателей в США. С момента основания в 1913 году, вплоть до 1957 года, когда компанию приобрёл концерн Procter & Gamble, отбеливатель на основе гипохлорита натрия Clorox Bleach® был единственным продуктом в её ассортименте.
Современная технологическая схема непрерывного производства гипохлорита натрия представлена на рисунке:
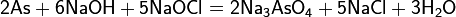
Низкосолевой процесс производства, в отличие от основной технологической схемы, представленной выше, включает в себя две стадии хлорирования, причём в кристаллизатор, где происходит концентрирование готового продукта, подаётся разбавленный раствор NaOCl из первого реактора:
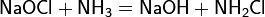
В России товарный гипохлорит натрия производят следующие предприятия:
- «Каустик», ЗАО;
- «Каустик», ОАО;
- «Новомосковский хлор», ООО;
- «Сода-хлорат», ООО.
Электрохимический метод
Электрохимический метод получения гипохлорита натрия заключается в электролизе водного раствора хлорида натрия или морской воды в электролизёре с полностью открытыми электродными зонами, то есть продукты электролиза свободно смешиваются в электрохимическом процессе.
Процесс на аноде:
Процесс на катоде:
Процесс в электролизёре за счёт химического взаимодействия образующихся продуктов:
Общая схема процесса:
Электрохимический метод используется, в основном, для получения дезинфицирующего раствора для систем водоочистки. Удобство этого метода заключается в том, что производство гипохлорита не требует поставок хлора, его можно производить сразу на месте водоподготовки, избежав, тем самым, расходов на доставку; кроме того, метод позволяет производить гипохлорит в достаточно широком диапазоне объёмов выработки: от очень малых до крупнотоннажных.
В мире существуют множество различных производителей электролизёров для получения растворов гипохлорита натрия, среди которых наиболее распространены системы компании Severn Trent De Nora: Seaclor и Sanilec.
Система Seaclor является преобладающей технологией производства гипохлорита натрия из морской воды электрохимическим методом, занимая свыше 70 % всех мировых мощностей. Более 400 установок Seaclor работают в 60 странах; их суммарная производительность составляет порядка 450 тыс. тонн NaOCl в год, единичная мощность колеблется в диапазоне 227—22 680 кг/день. Установки позволяют получать концентрацию активного хлора в растворе в диапазоне 0,1—0,25 %.
Установки Sanilec выпускаются производительностью от 1,2 до 21 600 кг/день, концентрация активного хлора составляет 0,05—0,25 %.
Характеристика продукции, обращение, хранение и транспортировка
В Российской Федерации гипохлорит натрия выпускается в соответствии с ГОСТ 11086-76 «Гипохлорит натрия. Технические условия». В соответствии с этим документом, по назначению NaOCl делится на две марки, характеристики которых представлены ниже:
| Наименование показателя | Марка А | Марка Б |
|---|---|---|
| Внешний вид | Жидкость зеленовато-жёлтого цвета | |
| Коэффициент светопропускания | Не менее 20 % | |
| Массовая концентрация активного хлора, г/дм³, не менее | 190 | 170 |
| Массовая концентрация щёлочи в пересчёте на NaOH, г/дм³ | 10—20 | 40—60 |
| Массовая концентрация железа, г/дм³, не более | 0,02 | 0,06 |
| Область применения | В химической промышленности для обеззараживания воды, дезинфекции и отбелки | В витаминной промышленности и для обеливания ткани |
Гипохлорит натрия должен храниться в защищённых от света, специальных полиэтиленовых, стальных гуммированных или других, покрытых коррозионно-стойкими материалами ёмкостях, наполненных на 90 % объёма и оборудованных воздушником для сброса образующегося при распаде кислорода. Перевозка продукции осуществляется в соответствии с правилами транспортировки опасных грузов.
Растворы товарного гипохлорита натрия со временем теряют свою активность из-за разложения NaOCl, что наглядно иллюстрирует следующая таблица:
| Концентрация NaOCl, % | Период полуразложения, дней | |
|---|---|---|
| 25 °C | 35 °C | |
| 15 | 144 | 39 |
| 12 | 180 | 48 |
| 9 | 240 | 65 |
| 6 | 360 | 97 |
| 3 | 720 | 194 |
| 1 | 2160 | 580 |
Просмотров: 29391
|
|