Химия - Химическая кинетика
01 марта 2011Оглавление:
1. Химическая кинетика
2. Порядок химической реакции
3. Молекулярность реакции
4. Катализ
5. Катализ в биохимии
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.
Скорость химической реакции
Важным понятием химической кинетики является скорость химической реакции. Эта величина определяет, как изменяется концентрация компонентов реакции с течением времени. Скорость химической реакции — величина всегда положительная, поэтому если она определяется по исходному веществу, то полученное значение домножается на −1.
Например для реакции
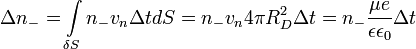 скорость можно выразить так:
скорость можно выразить так: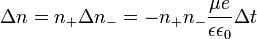
В 1865 году Н. Н. Бекетовым и в 1867 году К. М. Гульдбергом и П. Вааге был сформулирован закон действующих масс, согласно которому скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведённым в некоторые степени. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ, наличие катализатора, температура и площадь поверхности раздела фаз.
Просмотров: 4464
|
|