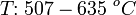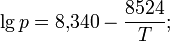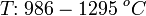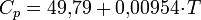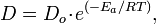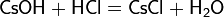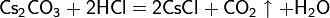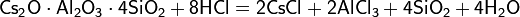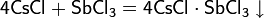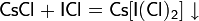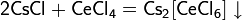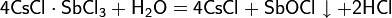Химия - Хлорид цезия - Химические свойства
28 февраля 2011Оглавление:
1. Хлорид цезия
2. Молекулярная и кристаллическая структура
3. Физические свойства
4. Получение
5. Химические свойства
6. Физиологическое действие и токсичность
Хлорид цезия при растворении в воде практически полностью диссоциирует на ионы, при этом в разбавленном растворе катионы цезия сольватированы:
В водных растворах вступает в типичные реакции обмена с некоторыми соединениями:
Твёрдый CsCl при нагревании с концентрированной серной кислотой или гидросульфатом цезия образует сульфат:
Очень слабый восстановитель, окисляется до хлора только с помощью сильных окислителей в жёстких условиях:
С некоторыми хлоридами образует смешанные соли: 2CsCl • BaCl2, 2CsCl • CuCl2, CsCl • 2CuCl, CsCl • LiCl и ряд других.
Вступает в реакцию с межгалогенными соединениями, образуя полигалогениды:
Применение
Хлорид цезия образуется как полупродукт при извлечении цезия из минерального сырья, а также как сырьё для металлотермического получения самого металла:
Соединение используют для получения гидроксида цезия — электролизом водного раствора соли:
Соединение было использовано для изучения ионов менделевия Md.
В радиоэлектронной промышленности хлорид цезия используется в вакуумных трубках для радио- и телеаппаратуры, производства рентгенофлуоресцентных экранов; в радиографии в качестве контрастного вещества.
Важным направлением использования CsCl является его применение в качестве рабочего раствора для ультрацентрифугирования белковых частиц в градиенте плотности. В методе равновесного центрифугирования требуется создание относительно высокой плотности раствора при одновременном сохранении вязкости среды. Хлорид цезия отвечает предъявляемым требованиям для высокоскоростного фракционирования ДНК, РНК, некоторых белков и нуклеотидов.
Прочие направления использования хлорида цезия включают:
- активация электродов при сварке молибдена;
- производство электропроводящего стекла;
- производство диоксида титана;
- производство буровых растворов;
- пивоварение и производство минеральной воды;
- реагент при определении жесткости воды методом измерения концентраций ионов кальция и магния пламенной атомно-абсорбционной спектрометрией;
- эффективный нетоксичный галогеноноситель для электроразрядных эксиплексных источников УФ-излучения;
- экспериментальный компонент флюсов для высокотемпературной пайки;
- экспериментальное средство для борьбы с насекомыми-вредителями некоторых сельскохозяйственных культур.
Применение в органической химии
Хлорид цезия относительно редко используется в органическом синтезе, однако описан ряд химических реакций, в которых применяется это соединение в качестве межфазного катализатора или нуклеофильного реагента:
- синтез производных глутаминовой кислоты:
- реакция замещения в тетранитрометане:
Применение в аналитической химии
Хлорид цезия находит широкое применение как аналитический реагент для проведения качественных реакций микрохимического обнаружения неорганических веществ по образованию характерных кристаллических осадков. Примеры частных микрокристаллоскопических реакций с использованием CsCl приведены в таблице:
| Обнаруживаемый ион | Сопутствующие реагенты | Состав осадка | Характеристика осадка | Предел обнаружения, мкг |
|---|---|---|---|---|
| AsO3 | KI | Cs2 или Cs3 | красные шестиугольники | 0,01 |
| Au | AgCl, HCl | Cs2Ag | почти черные крестики, четырех- и шестилучевые звезды | 0,01 |
| Au | NH4SCN | Cs | оранжево-жёлтые иглы | 0,4 |
| Bi | KI, HCl | Cs2 • 2,5H2O | красные шестиугольники | 0,13 |
| Cu | 2Pb, CH3COOH, KNO2 | Cs2Pb | черные мелкие кубы | 0,01 |
| In | — | Cs3 | мелкие октаэдры | 0,02 |
| — | Cs2 | тёмно-красные мелкие октаэдры | н/д | |
| Mg | Na2HPO4 | CsMgPO4 • 6H2O | мелкие тетраэдры | н/д |
| Pb | KI | Cs | жёлто-зеленые иглы, розетки | 0,01 |
| Pd | NaBr | Cs2 | буро-красные иглы и призмы | н/д |
| — | Cs | тёмно-красные ромбы, бипирамиды | 0,2 | |
| — | Cs2 | зелено-жёлтые мелкие октаэдры | 0,5 | |
| ReO4 | — | CsReO4 | тетрагональные бипирамиды | 0,13 |
| Rh | KNO2 | Cs3 | жёлтые кубы | 0,1 |
| Ru | — | Cs3 | розово-красные иглы, палочки | н/д |
| — | Cs2 | красно-бурые мелкие кристаллы | 0,8 | |
| Sb | — | Cs2 • nH2O | шестиугольники | 0,16 |
| Sb | NaI | Cs или Cs2 | красные шестиугольники | 0,1 |
| Sn | — | Cs2 | очень мелкие октаэдры | 0,2 |
| TeO3 | HCl | Cs2 | светло-жёлтые октаэдры | 0,3 |
| Tl | NaI | Cs | оранжево-красные шестиугольники, прямоугольники, кубы | 0,06 |
Используется хлорид цезия для следующих качественных аналитических реакций:
| Обнаруживаемый ион | Сопутствующие реагенты | Аналитическое определение | Предел обнаружения, мг/мл |
|---|---|---|---|
| Al | K2SO4 | в нейтральной среде после высушивания без нагревания — бесцветные кристаллы | 0,01 |
| Ga | KHSO4 | при небольшом нагревании выпадают бесцветные кристаллы | 0,5 |
| Cr | KHSO4 | в слабокислой среде при упаривании выпадают бледно-фиолетовые кристаллы | 0,06 |
Применение в медицине
Терапевтические свойства хлорида цезия были обнаружены ещё в 1888 году в лаборатории И.П.Павлова С.С. Боткиным. Соединение обладало выраженным гипертензивным и сосудосуживающим действием и было использовано для лечения нарушений сердечно-сосудистой системы.
Многочисленные клинические испытания показали, что хлорид цезия может быть эффективным противоопухолевым средством при комплексной терапии некоторых форм рака, однако использование этого препарата в настоящее время является экспериментальным и, по мнению American Cancer Society русск., требует дальнейшего изучения для оценки возможных рисков и последствий лечения.
Также в США был выдан патент на использование соединения в качестве стимулятора нервной системы. Отмечается, что CsCl очень эффективен для регулирования сердечной аритмии. В районах мира с повышенным содержанием солей цезия в рационе питания было отмечено увеличение продолжительности жизни. По предварительным экспериментальным данным хлорид цезия и другие его соли могут быть полезны для лечении маниакально-депрессивных расстройств. Терапевтическое действие соединения при лечении нейродегенеративных заболеваний связана с тем, что CsCl защищает нейроны от апоптоза и активации каспазы-3, вызываемых низким содержанием ионов калия.
Помимо обычного хлорида цезия, отдельное применение в лучевой диагностике и радиотерапии находит CsCl — хлорид металла, в котором используется радиоактивный изотоп цезия Cs. Другой радиоизотоп цезия Cs в виде хлорида также применяется как лечебно-диагностическое средство в брахитерапии и, в частности, прямой диагностики инфаркта миокарда.
По состоянию на 13 мая 2011 года хлорид цезия не входит в Перечень лекарственных средств, зарегистрированных, внесенных в государственный реестр лекарственных средств и разрешенных к медицинскому применению в Российской Федерации.
Просмотров: 8998
|
|